|
|
Vedi tutti gli articoli senza commenti
 |
Attenzione nuovi pericoli ci minacciano
|
 |
by
TORSALO Tuesday, Oct. 18, 2005 at 9:10 PM |
mail:
|
Il torsalo è una mosca che pianta le sue larve nella pelle di piccoli mammiferi come ratti, conigli ecc. ma anche cavalli, vacche ... ed udite udite anche persone !!!
Credetemi è molto doloroso, non ha cure e ti può anche uccidere se la larva di torsalo munita di ganci dorsali per meglio triturare la carne al suo passaggio passa per i polmoni, il cuore od altri organi vitali come il cervello.
Mangiato a sufficenza e già sviluppato in almeno un trimestre infernale, si scava un pertugio attraverso le tue carni fino ad uscire dalla tua epidermide !
Già ci sono stati dei casi in molti paesi europei, ma perchè nessuno ne parla?
Il fatto è che assieme ai prodotti che comperiamo sopratutto in centroamerica come frutta e verdura ci arriva di tutto, anche insetti: tarantole, vespe, mosche ... e anche il TORSALO, oltre che il famigerato DENGHE !!!
Bot Flies
(Family Oestridae)
Updated June 21, 2000
All images, unless otherwise noted, were created by staff from the University of Nebraska
Department of Entomology. They are freely available for use in publications and other media
as long as the "Department of Entomology, University of Nebraska-Lincoln" and the
photographer's name, if given, is credited.
tag
entomology.unl.edu/images/botflies/botflies.htm
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
La nuova peste mortale che con ali di mosca sta già svolazzando su tutta l' Europa !!!
|
 |
by
zzzzzzzzzzzzzzzzzzzzzzzzzzzz Tuesday, Oct. 18, 2005 at 9:22 PM |
mail:
|
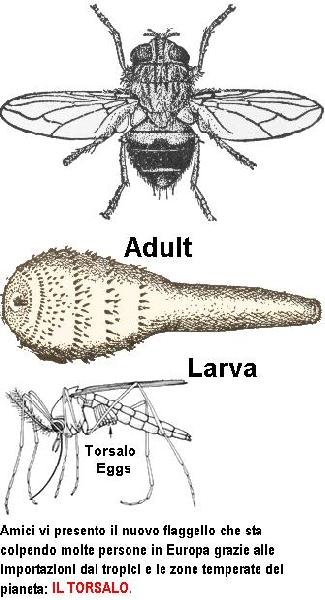
il_torsalo_-_la_nuova_peste_con_ali.jpg, image/jpeg, 335x618
Torsalo Fly
Dermatobia hominis
The Torsalo (or "human bot fly") is a member of the family Oestridae. It is native to the New World tropics where it is regarded as a pest because its larvae burrow under skin and live as internal parasites of warm-blooded animals. Torsalos are the only species of bot fly that manage to regularly parasitize humans.
Adult
An adult torsalo is a rather large insect (10-15 mm) with a bluish-black body, brown wings, and yellow markings on the face and legs. It is a loud, buzzing flier that tends to attract attention to itself -- unusual behavior for a parasite! Ordinarily, such a large, obnoxious insect would have difficulty approaching a large animal to lay eggs. But female torsalos overcome this problem by catching smaller flies (like mosquitoes) and gluing eggs to the underside of the captive's body. The captive is released unharmed, carrying the torsalo's eggs until it lands on a warm-blooded host. Body heat from the host triggers rapid hatching of the torsalo's eggs. The tiny maggots burrow quickly into the skin (even through clothing) and begin development as internal parasites.
Larva
Larvae develop over a period of 5-10 weeks, forming a painful boil or cyst under the skin. When mature, they emerge from the host, fall to the ground, and pupate. The adult fly emerges several weeks later.
The relationship between the torsalo and the fly that delivers its eggs is commensal (the torsalo benefits; the fly is unaffected). This type of symbiosis, in which one species uses another only as means of transportation, is also known as phoresy.
www.cals.ncsu.edu/course/ent591k/torsalo.html
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Il problema è reale
|
 |
by
un ricercatore Tuesday, Oct. 18, 2005 at 9:25 PM |
mail:
|
Il problema, oggi come oggi, in Europa, è solo per i polli e magari per qualche caso sporadico umano. Ed è un problema che le nazioni occidentali sono perfettamente in grado di circoscrivere.
Però tenete conto che i paesi asiatici non sono in grado di fare un bel niente nelle loro zone rurali. Molti esperti rilevano che nelle zone rurali cinesi manca una seria assistenza medica. I contadini malati evitano di recarsi presso gli ospedali e i medici specialisti, sia perché si trovano solo in città sia perché debbono pagare ogni visita e medicina, con costi molto superiori alle loro possibilità.
Quindi l'incubatrice resterà attiva.
Il problema grave sarà "quando il virus raggiungerà le megalopoli asiatiche o africane".
E poi da lì ...
Il sogno europeo ammalato di influenza
L'H5N1 si diffonde in tutto il mondo. Ma l'Unione europea sta a guardare
Monopolio Roche All'ultimo meeting dell'Oms Francia e Stati uniti hanno difeso l'attuale monopolio della Roche sul Tamilflu
MIKE DAVIS
L'influenza aviaria sta bussando alla porta dell'Unione europea, e non le sarà opposto un rifiuto. Nonostante le promesse dei responsabili nel campo veterinario e della salute pubblica, di sigillare i confini e stroncare così i nuovi focolai, l'H5N1 è una forza quasi irresistibile. È sconcertante come, nel corso dell'ultimo anno, l'Europa non abbia dimostrato alcuna coesione, né abbia attuato una seria pianificazione regionale sul modo migliore per affrontare lo spettro dell'influenza pandemica. Già l'anno scorso, i ricercatori avevano avvertito che l'influenza aviaria era diventata inestirpabile tra gli uccelli selvatici e il pollame domestico. La speranza iniziale che non fosse facilmente trasmissibile attraverso gli uccelli selvatici si è rivelata infondata questa primavera, quando i ricercatori cinesi hanno scoperto una enorme epidemia presso il lago Qinghai, nella Cina occidentale.
La Cassandra Yi Guan
Inizialmente il focolaio era limitato a un piccolo isolotto nel grande lago salato, dove le oche improvvisamente hanno cominciato ad avere convulsioni, per poi crollare al suolo e morire. A metà maggio l'intera popolazione aviaria del lago era infetta, e gli uccelli morivano a migliaia. Un ornitologo l'ha definita «l'influenza aviaria più grande e più mortale mai osservata negli uccelli selvatici». I virologi cinesi, nel frattempo, erano scioccati dalla virulenza del nuovo ceppo: quando i topi sono stati infettati dal virus di Qinghai, sono morti ancora più velocemente di quando gli era stato iniettato il «genotipo Z», la temibile variante N5N1 che sta attualmente uccidendo gli esseri umani in Vietnam e in Indonesia.
A luglio Yi Guan, leader del team di ricercatori di Hong Kong famoso in tutto il mondo che si occupa dell'influenza aviaria e combatte la minaccia della pandemia sin dal 1997, ha denunciato sul Guardian di Londra l'atteggiamento apatico mostrato dalle autorità cinesi nei confronti della conflagrazione biologica del lago Qinghai. «Non hanno preso quasi nessun provvedimento. Avrebbero dovuto chiedere il sostegno internazionale. Quegli uccelli andranno in India e in Bangladesh, e poi incontreranno altri uccelli provenienti dall'Europa». In un articolo pubblicato da Nature, Yi Guan e i suoi colleghi hanno anche rivelato che il ceppo di Qinghai probabilmente derivava da recenti episodi di influenza aviaria, non denunciati ufficialmente, tra gli uccelli della Cina meridionale. Questo ha confermato i sospetti che le autorità cinesi stessero continuando a nascondere al resto del mondo i focolai della malattia; in passato, avevano anche mentito sulla natura e sull'estensione dell'epidemia di Sars del 2003.
Come nel caso di allarmi lanciati in precedenza e relativi alla Sars, la burocrazia ha immediatamente preso provvedimenti contro Yi Guan per la sua onestà scientifica, chiudendo uno dei suoi laboratori alla Shantou University e armando il ministero dell'agricoltura, conservatore, di nuovi poteri di controllo sulla ricerca di base. Mentre Pechino censurava la ricerca, l'epicentro umano dell'influenza aviaria si stava espandendo: a metà luglio i funzionari della sanità indonesiani hanno confermato che un padre e le sue giovano figlie sono morti di influenza aviaria in un sobborgo benestante di Jakarta. Non risulta - un elemento preoccupante - che la famiglia fosse entrata in contatto con del pollame. Mentre la stampa speculava sulla possibile trasmissione tra esseri umani, nel quartiere è quasi scoppiato il panico.
Allo stesso tempo, cinque nuovi focolai di contagio tra polli sono stati riferiti in Thailandia. L'imbarazzante notizia è stata un duro colpo alla grande campagna lanciata nel paese, e ampiamente pubblicizzata, per sradicare la malattia. I funzionari vietnamiti, dal canto loro, hanno rinnovato gli appelli per l'aiuto internazionale mentre H5N1 mieteva nuove vittime nel paese che resta il focolaio centrale e preoccupa moltissimo l'Oms. Nel frattempo, gli uccelli del lago Qinghai avevano preso il volo per svernare nei cinque continenti. H5N1 puntualmente è arrivato alla periferia di Lhasa, la capitale del Tibet; è stato individuato in Kazakhstan e nella Mongolia occidentale; e, quel che più preoccupa, ha cominciato a uccidere polli e uccelli selvatici vicino alla capitale siberiana di Novosibirsk - a metà strada sulle rotte per il Mar Nero e l'Europa meridionale. L'arrivo dell'influenza aviaria in Iran, in Turchia e in Romania non è stato dunque una sorpresa: le sue prossime destinazioni potrebbero comprendere la Valle del Nilo, l'India meridionale, il Bangladesh, l'Australia, l'Alaska, il Canada settentrionale e, infine, il mondo intero.
L'H5N1 come Google
Anche se l'influenza aviaria non comportasse alcun pericolo per la salute umana, sarebbe comunque un cataclisma ecologico globale che minaccia devastazioni incalcolabili per gli uccelli selvatici, oltre che per i miliardi di polli che costituiscono attualmente la nostra seconda più grande fonte di proteine animali (la prima è costituita dai maiali, che ora stanno soccombendo anch'essi all'influenza aviaria).
Robert Wallace - uno scienziato della University of California che sta studiando come potrebbe diffondersi l'influenza pandemica - mi ha detto che H5N1 è «un motore di ricerca darwiniano più sofisticato di Google». Egli sostiene che il virus ci sta mettendo in scacco su quattro punti decisivi. Primo, «H5N1 sta volando sotto il radar sociale: gli esseri umani non sono stati ancora infettati, ma il ceppo si sta disseminando in regioni molto vaste. Esso sta cambiando non solo a livello molecolare, ma anche a livello epidemiologico». Secondo, «diffondendosi geograficamente, e infettando più polli, H5N1 allarga la base delle operazioni da cui può dare inizio a una pandemia». La strategia annunciata dall'Oms di saturare un focolaio - ad esempio, una regione rurale del Vietnam o della Thailandia - con il Tamiflu «non significa nulla, se H5N1 opera in tutto il mondo. In breve, cambiando la scala spaziale in cui opera, l'influenza modifica il mix di interventi che saranno necessari per fermarla». Terzo, «diffondendosi geograficamente, H5N1 entra in paesi che non hanno esperienza nell'individuare o combattere simili focolai». Quarto, «se la dispersione è correlata all'aumento del numero di polli infettati - e all'espansione dello spazio evolutivo in cui H5N1 deve agire - allora la velocità del contagio tra esseri umani si comprime». Il succo, in altre parole, è che ogni nuovo avamposto di H5N1, che sia tra i tacchini in Turchia, le oche in Siberia, i maiali in Cina, o gli esseri umani in Indonesia, rappresenta un'ulteriore opportunità per il virus in rapida evoluzione di acquisire il gene o anche, più semplicemente, le sostituzioni di amminoacidi di cui ha bisogno per massacrare esseri umani vulnerabili. Questa moltiplicazione esponenziale di «punti caldi» e di «serbatoi silenziosi» (come tra i contagiati da oche asintomatiche) è il motivo per cui nei Ministeri della Sanità di tutto il mondo stanno suonando i campanelli d'allarme.
Correva il 1918
Ci sono, naturalmente, gli scettici (anche se, di solito, non tra i virologi) i quali sostengono che l'influenza aviaria è soltanto una «minaccia teorica», e che un «fattore X» potrebbe impedire ad H5N1 di diventare facilmente trasmissibile tra esseri umani. Per la verità, molti ricercatori sono stupiti che non sia già scoppiata una pandemia, ma le evidenze dell'esistenza di un «fattore X» capace di inibire strutturalmente la mutazione di H5N1 in un omicida di massa, sono scarse. Piuttosto, è vero il contrario: ad agosto, un esperimento scientifico mozzafiato (e pericoloso) ha confermato somiglianze impressionanti tra l'attuale virus aviario e l'influenza del 1918 che uccise da 40 a 100 milioni di persone nell'autunno del 1918. Dopo un decennio di scrupoloso lavoro di laboratorio, quest'estate il team guidato da Jeffery Taubenberger dell'Istituto di patologia delle forze armate, alle porte di Washington, è riuscito a decifrare il suo genoma completo. In una scoperta che ha scioccato molti ricercatori, essi hanno rilevato che il virus del 1918 era un ceppo puramente aviario; esso era diventato trasmissibile all'uomo attraverso una serie di mutazioni sorprendentemente semplici. Questo significa che, dopo tutto, H5N1 potrebbe non dover «riassortire» i geni con un virus umano: esso potrebbe acquistare velocità pandemica attraverso la sua stessa modesta evoluzione.
In realtà, potrebbe già essere a mezza strada. Così, mentre H5N1 - che alcune anatre veicolano senza alcun sintomo - si aggira furtivamente ai margini dell'agricoltura dell'Ue, ci sono pochi motivi per ignorare gli avvertimenti ufficiali dell'Oms e di innumerevoli esperti secondo cui una pandemia è «imminente». «Imminente», naturalmente, potrebbe significare quest'inverno o il 2007.
Finora, i ministri della Sanità europei hanno agito come se l'Ue non esistesse. Ciascun governo ha fatto una valutazione indipendente del pericolo e ha agito di conseguenza. Inoltre, i governi europei stanno lavorando l'uno contro l'altro, entrando in competizione per la scarsità degli antivirali disponibili e discutendo se i polli debbano essere portati al chiuso oppure no. Soprattutto, l'Ue non ha tenuto in debito conto il fatto di essere la sede di tutta la produzione attuale di Tamiflu, e di detenere la maggiore capacità al mondo di produzione di vaccini per l'influenza. La sorveglianza del pollame è certo importante; ma ad essere veramente decisivo è il ruolo delle grandissime società farmaceutiche che hanno il loro quartier generale in Europa. Quando, a un meeting dell'Oms che si è tenuto quest'anno, la Thailandia e il Sudafrica hanno sollevato la questione della produzione generica di Tamilflu (oseltamivir) nel terzo mondo, la Francia e gli Stati uniti hanno unito le forze per proteggere l'attuale monopolio della Roche su questo farmaco. Analogamente, quando nel mese di agosto ho visitato il Programma sull'influenza dell'Oms a Ginevra, mi è stato detto che per il momento l'Oms aveva abbandonato qualsiasi speranza di un «vaccino mondiale» per combattere l'influenza aviaria, in gran parte perché non credevano nella volontà dell'Ue di assumersi l'impegno necessario per attivare appieno le sue linee di produzione di vaccino o di antagonisti della mutazione genetica per consentire l'uso di «ingegneria genetica rovesciata» (la tecnologia che ha reso possibile ricreare il virus del 1918).
Gli europei dovrebbero trarre una ben magra consolazione dalla situazione degli Stati uniti. Qui lo stato della «sicurezza nazionale» di Bush, dopo aver gettato via miliardi di dollari per rischi immaginari di bioterrorismo e per priorità di salute pubblica conosciute come «educazione all'astinenza», non ha fabbricato scorte di antivirale, né si è dotato di capacità produttiva di vaccini. Adesso c'è da aspettarsi che gli americani, specialmente se sono poveri e neri, saranno lasciati affogare da Washington. Ma l'Europa - almeno l'Europa immaginata dai socialisti e dai Verdi - dovrebbe aspirare a un diverso modello di civilizzazione rispetto al tipo di crudeltà e di incuria neo-liberale a cui abbiamo assistito recentemente nelle strade di Baghdad e di New Orleans.
La migrazione pericolosa
Nel contesto della minaccia dell'influenza aviaria, questo implica la responsabilità morale di attivare le straordinarie capacità farmaceutiche e scientifiche dell'Ue.
La migrazione più pericolosa di H5N1 nelle ultime settimane non è la sua vacanza nel Mar Nero, ma il suo movimento inesorabile verso le megalopoli dell'Africa e dell'Asia meridionale. Dovremmo essere estremamente preoccupati per l'imminente convergenza esplosiva di povertà urbana e influenza aviaria. Anche se l'Ue si muovesse collettivamente - come deve fare, con urgenza - questo sarebbe di scarsa utilità se una pandemia del tipo di quella del 1918 scoppiasse nelle grandi baraccopoli di Kinshasa o Mumbai. Tutti i polli in Europa potrebbero dormire al sicuro dentro i capannoni, ma se il seme demoniaco di H5N1 facesse presa nell'umanità devastata dall'Hiv dell'Africa sub-sahariana, presto salirebbe sul prossimo aereo per Roma, Londra o New York.
Né un nazionalismo epidemiologico stile fortezza, né una stupida reverenza per i profitti di Big Pharma (Roche in particolare) dovrebbero avere la meglio sul principio della solidarietà umana davanti al contagio (i contagi) in arrivo. La nostra comune sopravvivenza richiede un'ancora di salvezza adeguata sotto forma di vaccini, antivirali e antibiotici, che costituiscono un diritto umano. Che centinaia di milioni di persone povere attualmente non abbiano nemmeno accesso all'acqua potabile o all'aspirina è motivo di vergogna, ma non è una scusa per abbandonare il tentativo di creare un vaccino mondiale contro l'influenza il più presto possibile.
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
I Pericoli legati agli animali e alle piante
|
 |
by
dio bove Tuesday, Oct. 18, 2005 at 9:28 PM |
mail:
|
Quali malattie trasmettono le zanzare?
Abbiamo quattro tipi di zanzare e ognuna di loro trasmette delle malattie diverse, tra cui la malaria che è una delle principali cause di morte tra i viaggiatori e bisogna quindi premunirsi contro di essa:
1) ANOFELE: malaria/filariosi/linfatico
2) AEDES: arbovirosi/filariosi/linfatico
3) CULEX: arbovirosi/filariosi/linfatico
4) MANSONIA: arbovirosi/filariosi/linfatico.
Che cos’è un’arbovirosi?
L’arbovirosi è il termine con il quale si designano le virosi trasmesse dalle zanzare, dalle mosche e dalle zecche. Quando si manifesta di solito è associata ad almeno una delle cinque grandi sindromi (sindrome gialla/febbre con eruzione cutanea e-o artrite/attacchi polmonari/encefalite/febbre emorragica) ed il trattamento è sintomatico, associando riposo, antipiretici e antidolorifici.
Sono disponibili dei vaccini contro le arbovirosi?
Alcuni vaccini sono disponibili o in corso di sviluppo solo per alcuni tipi di virus, come quello della febbre della valle del Rift, dell’encefalite venezuelana ecc.
Quali sono i virus trasmessi dalle zanzare?
La febbre gialla
La febbre gialla è una virosi tropicale, diffusa solo in Africa e in America tropicale, urbana e rurale, trasmessa dalle zanzare Aedes e Haemagogues. I serbatoi del virus sono le scimmie e l’uomo. Esistono due tipi di febbre gialla: quella silvestre e quella urbana. Nel primo caso l’uomo è punto da una zanzara infettata dal sangue di una scimmia. Nel secondo caso il virus si trasmette all’uomo tramite un’altra zanzara (Aedes aegypti) provocando epidemie mortali nel 50% dei casi.
L’incubazione è di sei giorni, dopodiché la vittima presenta febbre alta, cefalee, dolori generalizzati e congestione del viso. Questo dura per tre o quattro giorni, finchè il malato si sentirà meglio (il meglio della morte). Ma dopo questa apparente remissione dei sintomi inizia la fase gialla, caratterizzata da ittero, da emorragie cutaneo-mucose e digestive e da conati di vomito di sangue nero (il vomito negro).
Dopodiché la malattia si può evolvere verso la guarigione, tra il quinto e il settimo giorno, o verso la morte, tra il sesto e il decimo giorno.
La dengue (febbre rompiossa – dengue emorragica)
La dengue è un’altra virosi tropicale diffusa nel Sudest asiatico, in Oceania, nei Carabi e in Sudameria, ed è urbana e rurale. Questa virosi si può presentare sotto forma di quattro tipi diversi, ed è trasmessa dalle zanzare Aedes che pungono nelle prime ore dell’alba e del tardo pomeriggio.
Le forme emorragiche raramente si manifestano nei turisti, che sono invece vittime della dangue classica, con febbre alta, dolori diffusi, disturbi digestivi e prurito frequente. Dopo una settimana inizia la convalescenza. Le forme emorragiche invece, che colpiscono i bambini autoctoni del Sudest asiatico, a volte portano alla morte.
L’encefalite giapponese
Si tratta anche in questo caso di una virosi tropicale, rurale, trasmessa dalle zanzare Culex che pungono dopo il tramonto. Questo tipi di encefalite è diffuso nelle zone di risicoltura dell’Asia, del Bangladesh, dell’india, dello Sri lanka, del Niger, della Birmania. Della Thailandia, del Laos, della Cambogia, della Cina, dell’Indonesia, del Bormeo, delle Filippine, della Corea e del Giappone.
L’evoluzione della malattia è seria: sei decessi, e cinque ricadute.
La vaccinazione è consigliata alle persone che effettuano lunghi viaggi in zone rurali dove la malattia è endemica.
Come proteggersi dalle zanzare?
Le zanzare che trasmettono la malaria pungono al calar della sera, quindi di notte bisogna indossare vestiti chiari e coprenti, e applicare sulle superfici scoperte dei prodotti repellenti.
Questi prodotti, pur se ben tollerati, hanno procurato alcuni casi di encefalopatia nei bambini dopo ripetute applicazioni. Per l’uso dei repellenti si possono seguire alcune regole:
- applicare su parti scoperte;
- non applicare sulle mucose o sulle piaghe;
- limitarne l’uso nelle donne in gravidanza, che allattano e nei bambini.
Durante la notte la presenza delle zanzare può essere limitata dall’uso del condizionatore e delle reti antizanzara, impregnate con l’insetticida, da applicare alle finestre.
Quali sono le malattie orofecali trasmesse dalle mosche?
Le mosche trasportano virus, germi microbici o parassiti dalle feci agli alimenti.
Le malattie principali sono: amebiasi, ascaridiasi, cisticercosi, colera, criptosporidiosi, diarrea del viaggiatore, echinococcosi idatidea e alveolare, epatiti virali, febbre tifoide, isosporosi, lambliasi, miasi, oncocercosi, poliomielite, salmonellosi, shigellosi, toxocariosi, toxoplasmisi e tripanosmiasi.
Che cos’è una tripanosomiasi?
Questa malattia, detta anche “malattia del sonno”, è localizzata nell’Africa occidentale e orientale, è dovuta ad un parassita trasmeso dalla glossina, o mosca tse-tse, che punge di giorno.
Colpisce raramente i viaggiatori e i turisti e comporta una prima fase linfatico-sanguigna con febbre moderata, irregolare, adenopatie e manifestazioni cutanee. In seguito si manifesta una meningo-encefalite con disturbi neuropsichici e letargia.
Che cos’è l’oncocercosi?
Si tratta di una malattia parassitaria diffusa in Africa, in America centrale e meridionale e a est dell’Oceano Indiano, causata dalla filaria Onshockerca volvulus e che viene trasmessa all’uomo da un insetto simile ad un moscerino. I sintomi sono: piccoli noduli sottocutanei che contengono le filarie, eruzioni cutanee pruriginose e lesioni oculari che possono portare alla cecità. Poco tempo fa, l’oncocercosi era la quarta causa di cecità nel mondo e, in alcune zone iperendemiche, più della metà della popolazione adulata è cieca a causa di questa malattia.
Che cos’è una miasi?
Le miasi sono provocate dall’inoculazione di una larva in una animale a sangue caldo. La larva di Cayor si contrae in Africa a contato con la biancheria o il terreno caldo e umido, dove le mosche hanno deposto le uova. La trasmissione della larva del Dermatobia hominis prevede in Sudamerica l’intervento di un insetto pungente al quale Dewrmatobia Hominis trasmette le sue uova.
Un buon sistema profilattico consiste nello stirare la biancheria con il ferro bollente per distruggere le uova deposte dalle mosche e, per quanto riguarda la larva presente nella pelle o nel cuoio capelluto, ci si può sbarazzare estraendola con una pinzetta.
Quali sono le malattie trasmesse dalle zecche?
Le zecche sono dei piccoli acari che possono trasmettere infezioni batteriche, una parassitosi e delle virosi, come le febbri emorragiche e l’encefalite verno –estiva russa.
Quali sono le caratteristiche delle febbri emorragiche?
Le febbri emorragiche, caratterizzate da una sindrome emorragica e/o un’encefalite, sono provocate da flavivirus trasmessi dalle zecche.
Ne fanno parte la malattia MFK e quella di FHO il cui periodo di incubazione va dai tre agli otto giorni. Inizia con febbre a 40°, cefalea, eruzione papulo - vascicolare e possono intervenire complicazioni.
La febbre emorragica di Crimea – Congo invece hanno una mortalità molto elevata e sono frequenti le epidemie. Nelle forme più gravi un’insufficienza epatorenale conduce alla morte tra il sesto ed il quattordicesimo giorno, nelle forme meno gravi lo stato del malato migliora a partire dal decimo giorno.
Come si presenta l’encefalite verno-estiva russa?
Si tratta di una virosi trasmessa dal morso di una zecca del genere Ixodus. E’ presente soprattutto nelle campagne ma sono stati riscontrati casi anche nei parchi pubblici, alla periferia delle grandi città dell’ Europa orientale e nei paesi dell’ex Unione Sovietica, in Danimarca, in Svezia e in Finlandia.
La trasmissione avviene durante il periodo di attività delle zecche, da maggio a ottobre, e sono particolarmente esposti al rischio di contagio gli escursionisti ed i campeggiatori.
Esiste un vaccino ed è disponibile anche in Italia.
Che cos’è la malattia di Lyme?
Si tratta di una malattia dovuta a un batterio della famiglia delle spirochete, trasmessa dalle zecche del genere Ixodes. Dopo il morso compare una lesione precoce estensiva, seguita un mese più tardi da manifestazioni neurologiche, cardiache o articolari. Tutti gli stadi della malattia rispondono agli antibiotici.
Per quanto riguarda la gravidanza, sono stati osservati dei rarissimi casi di trasmissione fetale , con bambini nati morti o morte neo-natale, quando la madre ha contratto la malattia precocemente e non è stata curata adeguatamente. Tuttavia c’è da dire che quasi tutti i bambini nati in tali circostanze stanno bene.
Come proteggersi dalle zecche?
Il rischio di contrarre una malattia attraverso le zecche è minimo e può essere ulteriormente limitato con l’uso di insetticidi e seguendo alcuni consigli di prevenzione:
- non camminare mai a piedi nudi nelle regioni infestate;
- non mettere la mano o il piede in un luogo che può nascondere qualcosa;
- scuotere le scarpe e i vestiti e non trascinarli per terra;
- chiudere ogni fessura con un telaio reticolato;
- in caso di sosta, durante una passeggiata, su un terreno impervio, pulire lo spazio sul quale vi istallerete.
Tutti i ragni mordono?
Soltanto alcuni, di tutti i ragni che vivono sulla superficie del globo, possono bucare la pelle umana, e solo una piccolissima percentuale è davvero pericolosa.
Il comportamento varia moltissimo da una specie all’altra e la gravità non è proporzionale al dolore del morso, e i rischi non sono in relazione con le dimensioni dell’animale.
Il veleno dei ragni è tossico?
Il veleno iniettato dalle specie pericolose è molto tossico, ma le quantità sono spesso minime così raramente questo risulta fatale. La maggior parte dei casi mortali riguarda bambini o soggetti indeboliti, in quanto lo stato di salute del soggetto morso è determinante per resistere agli effetti dell’avvelenamento.
Le “vedove nere” sono i ragni più velenosi. Anche se vivono a tutte le latitudini le specie più letali sono ai tropici. Il dolore si manifesta solo dopo un po’ dal morso e si estende progressivamente, accompagnato da contratture muscolari e da un senso di oppressione.
I migali sono grandi ragni pelosi tipici delle regioni calde. In Australia due specie vivono numerose attorno a Sydney e nel sud del paese, colonizzando giardini ed entrando facilmente nelle case.
Il genere Phoneutria è molto pericoloso e vive sulla costa orientale del Sudamerica. Il loro morso può essere mortale per i bambini.
I Loxosceles sono invece piccoli ragni e sono responsabili di avvelenamenti seri. Poichè il morso non è molto doloroso passa inosservato fino alla comparsa di una necrosi estesa della pelle, che impiega varie settimane a guarire.
Cosa fare in caso di morso di ragno?
In una zona a rischio bisogna dormire riparati da una zanzariera e, nel caso di scorpioni, è necessario non lasciare vestiti per terra e girare le scarpe con le suole verso l’alto. In caso di morso bisogna pulire la ferita per togliere il veleno in superficie e succhiare la piaga per eliminare il veleno in profondità, a patto di non avere ferite in bocca. In caso contrario sarà sufficiente applicare il Sani – Aspivenin e somministrare un antidolorifico. Il malato dovrà essere portato in ospedale o da un medico che somministrerà il siero specifico, in caso di recupero dell’animale, o un’ iniezioni di gliconato di calcio o di cortisone in caso contrario.
A che cosa è dovuta la leishmaniosi cutanea?
Si tratta di lesioni cutanee provocate dalle punture di insetti del genere Phlebotomus, di cui esistono tre specie nel Vecchio Continente, presenti dal bacino del Mediterraneo all’India, e una quindicina nel Nuovo Mondo.
Questi ditteri pungono la sera, quindi è bene prevenirli con zanzariere impregnate di piretrinoidi, e la malattia ha un’incubazione di minimo venti giorni a qualche mese. Alcune forme evolvono in maniera favorevole, altre decisamente più pericolose, provocano ulcerazione e distruzione delle mucose del viso.Le medicine impiegate sono derivati dell’antimonio, purtroppo assai tossici.
Che cos’è il tifo della boscaglia?
La febbre fluviale del Giappone è una rickettsiosi trasmessa da una larva di trombidio attraverso roditori selvatici o animali domestici. L’uomo viene punto quando attraversa una boscaglia immersa in un clima caldo e umido.
L’incubazione è di sette/dieci giorni. I sintomi sono: una febbre alta, dolori diffusi, iniezione congiuntivele, aspetto pseudotifico e transitoria eruzione maculo-papulosa. Nei casi gravi compare anche la tachicardia. Il cloramfenicol e le cicline assicurano una guarigione rapida.
Dove c’è il rischio di imbattersi negli scorpioni?
Gli scorpioni sono molto diffusi e vivono tra il 50° di latitudine nord e il 50° di latitudine sud, e fino a 3.000 metri di altezza. Non sono presenti in Madagascar, in Australia e sulle isole polinesiane.
Di solito lo scorpione caccia di notte e dorme durante il giorno, e punge solo se viene disturbato.
Solo una cinquantina delle 1.200 specie sono pericolose per l’uomo. La loro puntura può diventare mortale per un bambino e per una persona denutrita. Nel giro di cinque/dodici ore dalla puntura compaiono i sintomi più generali: sudore, nausea, vomito. In caso di avvelenamento serio compaiono anche febbre elevata e stato di confusione, e, in un soggetto debole, malato o nei bambini, la mancanza di cure può portare a complicazioni respiratorio, cardiovascolari e al coma.
Quali sono le precauzioni da prendere?
Soprattutto di notte non bisogna camminare a piedi nudi, né dormire per terra. Sarà bene controllare il sacco a pelo o le lenzuola, non lasciare per terra i vestiti e le scarpe, e controllarli accuratamente prima di indossarli.
Che cosa fare in caso di puntura di scorpione?
Innanzi tutto bisogna rassicurare la vittima, poiché l’agitazione accelera la diffusione del veleno nel sangue. Poi calmare il dolore con uno spray o un cubetto di ghiaccio e somministrare un antidolorifico. E’ assolutamente vietato far bere alcol alla vittima.
Se possibile, e senza farsi pungere, recuperare l’animale per identificarlo e trovare così un siero specifico. Portare subito la persona in ospedale, o da un medico, in quanto più la cura è tempestiva minori saranno le complicazioni.
I serpenti sono tutti velenosi?
Delle 2.700 specie di serpenti diffusi in tutto il mondo, solo 350 sono velenose. La maggior parte di essi non aggredisce l’uomo spontaneamente, ma è sensibile alle vibrazioni del terreno e scapperà se siete nelle vicinanze. Solo nel caso in cui questo non gli risulti facile, cercherà di spaventarvi.
C’è da dire però che il cobra e il mamba nero si comportano in modo completamente imprevedibile.
Quali sono le conseguenze del morso di un serpente?
In seguito al morso o allo sputo di un serpente, il veleno può creare grossi problemi. La gravità dipende molto dalla quantità del veleno iniettato, dall’età della vittima e dallo stato di salute. Solo in un piccolo numero di casi il veleno può causare la morte.
I serpenti velenosi, quali il cobra, il mamba, il serpente corallo e i serpenti marini, in alcuni paesi tropicali sono molto pericolosi. Bisogna quindi seguire delle importanti regole di comportamento:
- durante le camminate indossare stivali e pantaloni lunghi;
- battere il suolo con un bastone;
- non alzare le pietre a mani nude, non frugare in cavità nascoste e non salire sugli alberi con un fogliame fitto.
Che cosa fare in caso di morso?
Cercando di rassicurare la vittima ma senza dargli dell’alcol, disinfettare la piaga aspirando il veleno con il Sani-Aspivenin e somministrare un antidolorifico prima di condurre la persona presso un medico o un ospedale. Recuperare, se possibile, il serpente, anche se morto, per trovare un siero specifico.
La rabbia è presente ovunque nel mondo?
In pratica si. Secondo i dati 1996 dell’OMS i paesi immuni sarebbero: Australia, Bermude, Carabi (eccetto Cuba, Grenada, Haiti, Portorico e Trinidad), Danimarca, Spagna, Finlandia, Gibilterra, Grecia, Irlanda, Islanda, Giappone, Malta, Norvegia, Nuova Zelanda, le Isole del Pacifico, Papua Nuova Guinea, Portogallo, Regno Unito e Svezia, ma in compenso, in Asia, Africa e America Latina la rabbia è un problema di salute pubblica. Oltre a cani, gatti, sciacalli e volpi, gli animali vettori del virus della rabbia variano da paese a paese: possono essere i pipistrelli, le moffette, i procioni, le manguste e le scimmie.
Come proteggersi dalla rabbia?
Si raccomanda la vaccinazione preventiva, soprattutto ai viaggiatori che si recano in paesi in cui la malattia è endemica o che partono all’avventura. Attualmente per la immunoprofilassi della rabbia sono disponibili: il vaccino HDCV e quello PDEV.
La vaccinazione preventiva comunque non esime dalla necessità di farsi somministrare prontamente un trattamento antirabbico dopo un contatto con un animale malato o il cui comportamento è sospetto.
Quando e dove farsi vaccinare contro la rabbia?
Rivolgendosi al proprio medico curante si riceveranno tutte le informazioni necessarie. In ogni caso il vaccino andrebbe somministrato nei tre mesi che precedono la partenza, soprattutto se devono essere effettuate altre vaccinazioni.
Esistono delle controindicazioni?
La vaccinazione preventiva è controindicata in gravidanza, mentre la vaccinazione curativa dopo che si è stati morsi da un cane sospetto non ha nessuna controindicazione, in quanto l’encefalite rabbica è mortale.
Il tetano può essere trasmesso da un morso o da un graffio?
Si, in quanto il tetano è una tossinfezione dovuta ad un bacillo, e la trasmissione avviene in occasione di una caduta, una puntura di vegetali, un morso o una leccata da parte di animali. Ci si protegge dal tetano con la vaccinazione.
Quali sono le piante con foglie o fusto tossici?
Nelle Antille e in America centrale e meridionale cresce un albero alto da cinque a sette metri della famiglia delle Euforbiacee, la mancinella, che secerne un lattice caustico molto velenoso, che viene anche usato per produrre delle frecce avvelenate, ed un frutto altrettanto velenoso. In caso di allergie il contatto con il lattice di altri alberi tropicali quali l’ebano, il tek, il mogano, il palissandro, i succhi di betel, l’agave, l’euforbia e il fico d’India, può provocare delle reazioni serie.
Quali sono gli alberi i cui frutti sono tossici?
Nelle foreste tropicali esistono molte bacche appetitose, che però possono rivelarsi anche mortali. Il frutto acerbo dell’Alichia sapida, ad esempio, ha provocato la morte di alcuni bambini mentre il frutto maturo è commestibile. L’albero di Cognac produce un frutto commestibile a piccoli dosi, ma letale se assunto in grandi quantità. Le foglie e i fiori dell’oleandro, molto diffuso dalle nostre parti, sono velenosi.
In generale, quindi, non bisogna mai mangiare bacche che non si conoscono.
Quali sono le precauzioni da prendere?
Innanzi tutto bisogna informarsi dalle gente del luogo sulle varie piante e impedire ai bambini di raccogliere le bacche e mangiarle. Se gli occhi dovessero venire a contatto con la linfa o il lattice di un albero velenoso, bisognerà sciacquarlo abbondantemente con acqua borica e consultare un medico.
Quali sono gli invertebrati marini velenosi?
Esistono alcuni invertebrati marini che possono infliggere delle punture o dei morsi assai gravi, a volte mortali. Abbiamo ad esempio i conus del pacifico tropicale, i polpi, alcune stelle marine, i ricci di mare, i Cnidarii, le meduse e gli anemoni di mare. Per non parlare delle ferite o i tagli dovuti ai coralli.
La maggior parte di queste ferite, ma anche il contatto con le meduse, può essere evitata con l’uso della muta, della maschera e dei guanti da sub.
Quali sono i pesci velenosi?
Abbiamo alcune razze di pesci dotate di aculeo come la pastinaca e l’aquila di mare che sono ben note in Europa. Per quanto riguarda i tropici segnaliamo le Urolophidae e le Rhinopteridae. I pesci ragno, invece, che sono presenti lungo le coste sabbiose o fangose dell’Atlantico, della Manica e del Mediterraneo, gli scorfani che sono diffusi nei mari temperati o caldi e che comprendono tre sottofamiglie, tutte pericolose, i pesci pietra che vivono sepolti nella sabbia o nella melma dei mari tropicali e i pesci zebra che vivono in acque profonde all’interno di scogliere coralline.
Ricordiamo inoltre che anche i seguenti pesci sono velenosi: la rana pescatrice, il pesce astronomo e il pesce gatto.
Quali sono le precauzioni da prendere?
Esistono alcuni rimedi locali che mirano a inattivare il veleno oltre ai rimedi più generali, quali la corticoterapia e la terapia antibiotica, che mirano a ridurre gli effetti della tossina nell’organismo.
Per la puntura del pesce pietra invece esiste uno specifico siero contro il veleno.
Quali sono i pesci responsabili di morsi velenosi?
Tra questi troviamo la murena, il cui morso causa il decesso solo in casi eccezionali, che attacca l’uomo solo se si sente minacciata e può essere pericolosa anche dopo diverse ore trascorse fuori dall’acqua.
Nella fascia tropicale degli oceani, invece, vivono i serpenti di mare, il cui apparato velenifero è affine a quello dei serpenti terrestri e il cui morso è quasi indolore. L’esito è fatale solo nel 20 – 30% dei casi e può avvenire dopo qualche ora per collasso cardiocircolatorio, oppure nel giro di pochi giorni per insufficienza renale acuta.
Sono frequenti gli attacchi di squalo?
Anche se gli squali costituiscono una minaccia per gli appassionati di sport nautici, il numero di attacchi è esiguo se confrontato con gli altri pericoli legati alle immersioni subacquee.
Che cosa fare in caso di morso di squalo?
In caso di morso di squalo, se ci si trova in acqua, bisogna formare un cerchio attorno alla vittima per evitare un ulteriore attacco da parte dell’animale e bloccare il flusso del sangue con un laccio.
Fuori dall’acqua, invece, bisogna far coricare la vittima con la testa in basso, all’ombra e al fresco, e cercare di arrestare l’emorragia. In ogni caso è necessario chiamare subito un medico che sottoporrà il ferito a fleboclisi.
Come proteggersi dalle aggressioni degli squali?
Se siete bagnanti e nuotatori
Bisognerà seguire le seguenti regole:
- non tuffatevi mai da soli;
- non allontanatevi troppo dal gruppo dei bagnanti;
- non fate il bagno in acque infestate dagli squali;
- non nuotate se avete ferite non cicatrizzate o sanguinanti;
- non tuffatevi dove la visibilità sottomarina è ridotta;
- tenetevi alla larga dagli estuari, perché il pericolo arriva sia dal fiume che dal mare.
Se siete sub:
Non dimenticate di seguire questi consigli:
- non tuffatevi mai da soli;
- premunitevi sempre di una barca d’appoggio durante le immersioni;
- evitate le zone infestate dagli squali;
- non tuffatevi di notte in acque agitate e, in caso di necessità, abbiate sempre a disposizione una gabbia antisqualo;
- se doveste trovarvi faccia a faccia con uno squalo non perdete la calma e, se dovesse mostrarsi minaccioso, gridate;
- non pescate in acque infestate dagli squali;
- se scorgete uno squalo e avete con voi del pesce, sbarazzatevene;
- evitate di inseguire uno squalo in un vicolo cieco o attaccarlo, poiché scatenereste una sua reazione di difesa;
- se uno squalo vi punta e cerca di aggredirvi, colpitelo con un oggetto solido di una certa lunghezza;
- durante un’esplorazione, il vostro compagno dovrà trovarsi in posizione arretrata per controllare ciò che sfugge a voi;
- se gli squali fossero più di due, anche se la squadra fosse composta da tre sub, è consigliabile risalire verso la barca, schiena a schiena, oppure rifugiarsi in una gabbia antisqualo;
- prima di salire sulla barca controllate l’acqua intorno a voi perché lo squalo sceglierà proprio quel momento per attaccare, visto che sarete costretti ad abbassare la guardia.
Quali sono gli altri pesci che infliggono morsi non velenosi?
I barracuda
Anche se in alcune zone i barracuda sono più temuti degli squali, in generale la loro aggressione è meno pericolosa poiché l’animale attacca e poi si allontana definitivamente, senza insistere.
Gli Scombridi
Le fotografie scattate ai morsi degli Scombridi mostrano quanto sia difficile distinguerli da quelli di uno squalo, poiché sono davvero molto simili.
Infatti, senza le spoglie del pesce aggressore, è difficile identificare la specie responsabile.
Il thazard
Il thazard può misurare fino a due metri e pesare oltre sessanta chilogrammi. I bordi della ferita sono netti, come se si trattasse di una coltellata.
Le orche attaccano gli uomini?
L’”orca assassina” è l’unico mammifero marino che attacca l’uomo. E’ lunga da sei a nove metri, divora i pinguini e i trichechi, a volte attacca anche le balene, e frequenta di solito le acque fredde nelle quali caccia in branco.
Ci sono i coccodrilli marini?
Il coccodrillo africano cresce anche nell’acqua salata, può essere lungo più di quattro metri e in alcune zone attacca l’uomo. Il coccodrillo marino delle regioni dell’India e delle Indie orientali, invece, è più lungo del precedente ed è un mangiatore di uomini.
Quali sono le minacce portate dalla flora marina?
I Dinoflagellanti planctonici sono organismi unicellulari responsabili del fenomeno della “marea rossa”, che può provocare nell’uomo un’intossicazione digestiva o respiratoria.
Che cos’è il fenomeno della “marea rossa”?
Il fenomeno prende il nome dal colore rosso sangue assunto dall’acqua. Non si può comunque fornire una descrizione tipica della marea rossa poiché il colore varia a seconda dell’organismo responsabile. Quando il fenomeno assume una certa importanza e dura a lungo, può avere effetti catastrofici sulla fauna marina.
Quali sono le conseguenze della marea rossa per l’uomo?
Una prima forma d’intossicazione può essere quella respiratoria, poiché si tratta di un vero e proprio aerosol che trasmette quantità minime di “marea rossa” alle persone che abitano in riva al mare. Molto più pericolosa è l’intossicazione digestiva tramite i pesci, i crostacei e i molluschi contaminati. Oltre ai disturbi digestivi si manifestano quelli cardiovascolari e un prurito intenso localizzato sul palmo della mano e sulla pianta dei piedi.
Come proteggersi dalla marea rossa?
Per evitare le intossicazioni respiratorie è sufficiente premunirsi di un tampone d’ovatta che protegga naso e bocca, mentre per gli effetti, questi vengono attenuati da aerosol di corticoidi.
Per quelle digestive invece è fondamentale evitare la pesca o la raccolta di frutti di mare nei pressi della marea rossa.
www.paesionline.it/s_animali_piante.asp
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
DIPTERA HIPPOBOSCOIDEA, OESTROIDEA
|
 |
by
Thomas Pape, Vera Richter, Leo Rivosecchi e K Tuesday, Oct. 18, 2005 at 9:33 PM |
mail:
|
Fascicolo 78
DIPTERA HIPPOBOSCOIDEA, OESTROIDEA
Thomas Pape, Vera Richter, Leo Rivosecchi e Knut Rognes
Il presente fascicolo raccoglie l'opera di quattro ricercatori a cui spetta la responsabilità delle rispettive sezioni, sia per le liste di specie che per i testi introduttivi e le note:
L. RIVOSECCHI - Hippoboscidae, Streblidae, e Nycteribiidae (generi 001-015)
K. ROGNES - Calliphoridae (generi 016-034)
T. PAPE - Sarcophagidae (generi 035-083), Rhinophoridae (generi 084-093) e Oestridae (generi 316- 322)
V. RICHTER - Tachinidae (generi 094-315)
HIPPOBOSCIDAE Si includevano un tempo nel gruppo dei Ditteri Pupipari assieme a Streblidi e Nicteribidi. Tale raggrupamento era però considerato innaturale (Falcoz, 1926) in quanto la deposizione da parte delle femmine di larve mature che rapidamente si trasformavano in pupari si poteva osservare anche in altri Ditteri. In particolare era stata messa in evidenza la stretta affnità tra Ippoboscidi e Glossinidi (Zavattari, 1929), ipotizzando persino un comune antenato muscoide nidicolo (Oldroyd, 1964).
Gli Ippoboscidi hanno colorazione bruno-rossastra e facies caratterizzata dall'appiattimento dorso-ventrale; sono ectoparassiti ematofagi di uccelli o mammiferi, le forme mobili hanno ali e organi visivi ben sviluppati, quelle fisse organi visivi rudimentali, brachitterismo o atterismo. Si dividono in due sottofamiglie le Hippoboscinae (associate a uccelli, salvo il genere Hippobosca) e le Lipopteninae, tutte associate a mammiferi. Dei dodici generi presenti nella fauna paleartica almeno 10 si possono includere in quella italiana e vengono raggruppati in varie tribù che non riteniamo opportuno menzionare nella presente lista. Delle 55 specie note per la fauna paleartica solo 25 appartengono a quella europea. La fauna italiana con solo 18 specie non si direbbe completamente ben conosciuta. Attualmente è oggetto di ricerche da parte del Prof. Manilla cui sono grato per varie comunicazioni personali su Ippoboscidi associati ad uccelli in Italia.
STREBLIDAE Nei Ditteri di questa famiglia si osserva, come negli Ippoboscidi, una serie di variazioni riduttive delle ali e degli occhi che culmina nelle femmine di Ascodipteron nella perdita di zampe, ali e bilancieri e nel processo di trasformazione in vescicole membranose.
Sono tutti ectoparassiti ematofagi di Chirotteri non ibernanti e quindi diffusi particolarmente nelle regioni tropicali e neotropicali. Solo 10 specie nella fauna paleartica di cui una sola nella nostra fauna, nota dapprima per la sola Sardegna e poi ritrovata anche nell'Italia meridionale.
NYCTERIBIIDAE Gli adattamenti morfologici alla vita parassitaria già visti nella famiglia degli Ippoboscidi, come la regressione degli organi della vista e del volo si accentuano in questa famiglia ove in ogni caso si ha atterismo. Il corpo è fortemente appiattito in senso dorso-ventrale, il torace è provvisto ventralmente di robuste spine (ctenidi) e le zampe di grosse unghie sicché in definitiva si può osservare in questi Ditteri una vera e propria facies "aracnoide".
Sono tutti ectoparassiti ematofagi di Chirotteri. Le specie della fauna paleartica sono 34 di cui 25 estremo o medio orientali; 9 specie europee tutte presenti in Italia. Difficilmente questo numero potrà essere aumentato anche perchè a differenza di quanto si è verificato per altri Ditteri, questi hanno sempre suscitato l'interesse di vari studiosi; zoologi, parassitologi, speleologi attratti dalla peculiarutà della loro morfologia e biologia.
CALLIPHORIDAE I Calliforidi sono abbondanti in tutta Europa, ma la fauna italiana è nel complesso poco conosciuta sicché è ragionevole aspettarsi che in futuro verranno scoperti specie e generi nuovi per la fauna italiana. Delle 109 specie europee (324 specie nella regione Paleartica), 59 appartengono alla fauna italiana (Rognes, inedito). La classificazione qui seguita è quella di Rognes (1991a). Di conseguenza, Eurychaeta (=Helicobosca) è considerata appartenente ai Calliphoridae piuttosto che ai Sarcophagidae (cf. Rognes 1986, 1993). La nomenclatura segue Schumann (1986), ma è aggiornata con riferimento al lavoro di Rognes (1987a) e successivi. Tutti i sinonimi descritti o noti per l'Italia sono inclusi nella lista.
Il classico lavoro sui Ditteri italiani di Camillo Rondani (1807-79) è stato incorporato nell'opera di autori più recenti. I dati faunistici della presente lista derivano parzialmente dai lavori di Bezzi (1891, 1892, 1894a, 1894b, 1895, 1918, 1925), Bezzi & De Stefani-Perez (1897), Corti (1893, 1894, 1897), Tuccimei (1911), Zangheri (1950, 1969), Di Girolamo & Mancini (1987) e Caoduro, Osella & Ruffo (1994). Dati faunistici sono tratti inoltre da Séguy (1928), Zumpt (1956), Herting (1961), Peris (1952), Peus (1960) e Schumann (1964, 1974). Per Pollenia, i dati provengono dalla mia revisione di questo genere (Rognes 1987a, 1987b, 1988, 1991b, 1991c, 1992a, 1992b). In aggiunta, ho incluso dati per l'Italia basati sulle mie determinazioni di varie collezioni mondiali. Sfortunatamente non ho potuto riesaminare la collezione Rondani al Museo Zoologico 'La Specola' di Firenze (eccetto il materiale di Pollenia, cf. Rognes 1991c) e nemmeno la collezione Venturi presso l'Istituto di Entomologia Agraria dell'Università degli Studi di Pisa. Comunque ho lavorato su una piccola collezione di Calliphoridae indeterminati mandatami dal Dr. Guido Campadello dell'Istituto di Entomologia 'Guido Grandi' dell'Università degli Studi di Bologna. A lui va il mio ringraziamento.
La lista non include i seguenti nomina dubia: Pollenia olivacea Macquart, 1835: 270 (località tipo: Sicilia); Pollenia violacea Macquart, 1835: 270 (località tipo: Sicilia); Musca ruficeps Meigen, 1838: 306 (località tipo: Sicilia); Somomya fulvifrons Rondani, 1865: 228 (località tipo: "in alpibus Insubriae [...]")
SARCOPHAGIDAE La famiglia comprende circa 2500 specie a distribuzione mondiale, di cui 780 nella regione paleartica. La prima lista attendibile delle specie italiane fu redatta da Saccà & Rivosecchi (1953), per le specie dei generi Sarcophaga e Ravinia, e da Venturi (1960), per le rimanenti. La presente checklist raccoglie tutte le specie descritte nel catalogo paleartico di Verves (1986) e numerose altre specie identificate dall’autore (in totale 158). I generi sono elencati in ordine alfabetico e divisi nelle sottofamiglie Miltogrammatinae, Paramacronychiinae e Sarcophaginae; specialmente all’interno di quest’ultima sottofamiglia i generi Blaesoxipha e Sarcophaga sono intesi in senso lato.
RHINOPHORIDAE È una piccola famiglia con poco più di 100 specie descritte. Della regione paleartica sono note circa 80 specie tutte parassite obbligate e abbastanza specifiche di Isopodi. La presente lista ne riporta 22 per l'Italia. Per un'accurata introduzione alla famiglia e un inquadramento filogenetico del gruppo si vedano i lavori di Crosskey (1977), Wood (1987) e Pape (1986).
La monografia e il catalogo delle specie paleartiche curati da Herting (1961, 1994) includono i generi Angioneura, Melanomya e Morinia che nella presente checklist sono considerati tra i Calliphoridae.
TACHINIDAE È la famiglia di Ditteri più numerosa con più di 1600 specie descritte nella regione paleartica. Le specie conosciute del nord e centro Europa sono 591 (Tschorsnig & Herting, 1994). La fauna italiana comprende 474 specie; i dati faunistici della presente checklist sono ricavati dai lavori sulla regione paleartica di Mesnil (1944-1975, 1980) e Herting (1960, 1983, 1984) e numerose altre pubblicazioni italiane.
OESTRIDAE (incl. Gasterophilidae) Sono parassiti obbligati di mammiferi; alcune specie possono causare significative perdite economiche all’industria dell’allevamento. La famiglia comprende circa 47 specie a diffusione paleartica, di cui 14 sono note per l'Italia. Le larve di Dermatobia hominis (Linnaeus, Jr.) parassita umano, sono state introdotte accidentalmente in Italia dai turisti di ritorno da soggiorni nella regione neotropicale (Di Deco et al. 1981).
Si deve ai lavori di Wood (1987), Scholl (1993), Grunin (1965, 1966, 1969) e Soós & Minár (1986) lo stato di conoscenza attuale della famiglia nella regione paleartica.
BIBLIOGRAFIA
HIPPOBOSCIDAE
FALCOZ L., 1926. Diptères Pupipares (Faune de France, 14). Lechevalier, Paris.
FIORI A., 1880. Di alcune Hippoboscite del Modenese, Bull. Soc. ent. It., 12: 12-13.
MANILLA G., 1995. Contributo alla conoscenza delle specie Hippoboscidae degli uccelli in Italia. Fragm. Ent., in stampa.
OLDROYD H., 1964. The natural history of flies. Weidenfeld and Nicolson, London.
RIVOSECCHI L., KHOURY C., CAVALLINI C. & STELLA E., 1982. Artropodi amatofagi delle aree naturali da proteggere - Nota III- Lipoptena cervi (Dipt. Hippoboscidae) nel parco di Castel Porziano. Atti VIII Simpos. cons. Nat., 8 (1979): 183-196.
RONDANI C., 1879, Hippoboscita italica in familias et genera distribuita, Bull. Soc. ent. It., 11: 3-28.
SOÓS Á. & HURKA K., 1986. Family Hippoboscidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 11. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 215-226.
THEODOR O. & OLROYD H., 1964. Hippoboscidae. In: Lindner E. (ed.), Die Fliegen der palaearktischen Region, XII, 65. Schweizerbart, Stuttgart.
ZAVATTARI E., 1928. Le affnità morfologiche ed etologiche tra Hippoboscidae e Glossinidae, Atti soc. It. sc. nat., 67: 37-70.
STREBLIDAE
LANZA B., 1950. La Nycteribosca africana (W.) in Italia. Mem. Soc. ent. It., 29: 96.
LA GRECA M., 1946. Sulla presenza di Nycteribosca africana (Walk.) in Italia. Boll. soc. ent. It., 76: 79.
HURKA K. & SOÓS Á., 1986. Family Streblidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 11. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 234-236.
THEODOR O., 1954. Nycteribiidae & Streblidae In: Lindner E. (ed.), Die Fliegen der palaearktischen Region, XII, 66a-66b. Schweizerbart, Stuttgart.
NYCTERIBIIDAE
CORRADETTI A., 1934. Sui Nycteribidi della campagna romana, Riv. Malariol., 13: 338-352.
HURKA K. & SOÓS Á., 1986. Family Nycteribiidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 11. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 226-234.
PAVAN M., 1941. Appunti sui Nycteribiidae. Riv. Parass., 5: 101-108.
SACCÀ G. & BETTINI S., 1949. Nycteribiidae della Sardegna. Riv. Parass., 10: 69-70.
STEFANELLI A., 1942. Affinità sistematiche dei Chírotteri e parassitismo dei Nycteribiidae (Dipt. Pupipara). Riv. Parass., 6: 25-42; 61-86.
STEFANELLI A., 1948. Studi sui Chirotteri della Sardegna e sui loro ectoparassiti, Rend. seminari Fac. di Scienze, 17: 80-83.
RICCI M., 1953. Contributo alla conoscenza degli ectoparassiti dei Chirotteri, Riv. Parass., 14 (4), 219-226.
THEODOR O., 1967, An illustrated catalogue of the Rotschtld collection of Nycteribiidae in the British Museum. British Museum of natural History, London.
CALLIPHORIDAE
BEZZI M., 1891a. Contribuzione alla fauna ditterologica della provincia di Pavia. Parte prima. Boll Soc. ent. It., 23: 21-91.
BEZZI M., 1892b. Contribuzione alla fauna ditterologica della provincia di Pavia. Parte seconda. Continuazione. Boll Soc. ent. It., 24: 97-151.
BEZZI M., 1894a. I ditteri del Trentino. Saggio di un elenco delle specie di ditteri finora osservate nel Trentino. Atti Soc. ven.-trent. Sc. nat. (Ser. 2), 1 (1): 209-272.
BEZZI M., 1894b. I ditteri del Trentino. Saggio di un elenco delle specie di ditteri finora osservate nel Trentino. (Cont.). Atti Soc. ven.-trent. Sc. nat. (Ser. 2), 1 (2): 275-353.
BEZZI M., 1895. Contribuzioni alla fauna ditterologica italiana. I. Ditteri della Calabria. Boll. Soc. ent. It., 27: 39-78.
BEZZI M., 1918. Studi sulla ditterofauna nivale delle Alpi italiane. Memorie Soc. Ital. Sci. nat., 9 (1): 1-164.
BEZZI M., 1925. Materiali per una fauna dell'Arcipelago Toscano. XVII. Ditteri del Giglio. Ann. Mus. civ. St. nat. Giacomo Doria, 50: 291-354.
BEZZI M. & DE STEFANI-PEREZ T., 1897. Enumerazione dei ditteri fino ad ora raccolti in Sicilia. Naturalista sicil., 2: 25-72.
CAODURO G., OSELLA G. & RUFFO S., 1994. La fauna cavernicola della regione veronese. Mem. Mus. Civ. St. Nat. Verona, (II Serie), Sezione Scienze della Vita (A: Biologica), 11: 1-144.
CORTI E., 1893. Aggiunte alla fauna ditterologica della provincia di Pavia. Boll. Soc. ent. It., 25: 33-41.
CORTI E., 1894. Aggiunte alla fauna ditterologica della provincia di Pavia. Boll. Soc. ent. It., 26: 389-395.
CORTI E., 1897. Aggiunte alla fauna ditterologica della provincia di Pavia. Boll. Soc. ent. It., 29: 136-143.
DI GIROLAMO I. & MANCINI L., 1988. Le mosche sinantropiche della collezione ditterologica dell'lstituto Superiore di Sanità (ex collezione Saccà) (Diptera, Brachycera). Boll. Ass. Rom. Entom., 42 (1987): 21-35.
HERTING B., 1961. Rhinophorinae. In: Lindner E. (ed.), Die Fliegen der palaearktischen Region, IX, 64e. Schweizerbart, Stuttgart.
PERIS S.V., 1952. La subfamilia Rhiniinae (Dipt. Calliphoridae). Anales Estacion exp. Aula Dei, 3 (1): 1-224.
PEUS F., 1960. Zur Kenntnis der ornithoparasitischen Phormiinen (Diptera, Calliphoridae). Dt. ent. Z. (N. F.), 7: 193-235.
ROGNES K., 1986. The systematic position of the genus Helicobosca Bezzi with a discussion of the monophyly of the calyptrate families Calliphoridae, Rhinophoridae, Sarcophagidae and Tachinidae (Diptera). Ent. scand., 17: 75-92.
ROGNES K., 1987a. A new species in the intermedia-goup and a new synonymy in the genus Pollenia Robineau-Desvoidy, 1830 (Diptera: Calliphoridae). Syst Ent., 12: 381-388.
ROGNES K., 1987b. The taxonomy of the Pollenia rudis species-group in the Holarctic Region (Diptera: Calliphoridae). Syst. Ent., 12: 475-502.
ROGNES K., 1988. The taxonomy and phylogenetic relationships of the Pollenia semicinerea species-group. Syst. Ent., 13: 315-345.
ROGNES K., 1991a. Blowflies (Diptera, Calliphoridae) of Fennoscandia and Denmark (Fauna entomologica scandinavica, 24). Brill, Leiden / Scandinavian Science Press, København.
ROGNES K., 1991b. Revision of the cluster-flies of the Pollenia viatica species-group (Diptera: Calliphoridae). Syst. Ent., 16: 439-498.
ROGNES K., 1991c. Revision of the species of Pollenia Robineau-Desvoidy described by Camillo Rondani (Diptera: Calliphoridae). Ent. scand., 22: 365-367.
ROGNES K., 1992a. Revision of the cluster-flies of the Pollenia vagabunda species-goup (Diptera: Calliphoridae). Ent. scand., 23: 95-114.
ROGNES K., 1992b. Revision of the cluster-flies of the Pollenia venturii species-group, with a cladistic analysis of Palaearctic species of Pollenia Robineau-Desvoidy (Diptera: Calliphoridae). Ent. scand., 23: 233-248.
ROGNES K., 1993. A new genus of Helicoboscinae from the Himalayas (Diptera: Calliphoridae), with emended genus and subfamiliy concepts. Ent. scand, 23: 391-404.
ROGNES K., inedito. Family Calliphoridae. With an appendix: Draft of revised catalogue of Palaearctic Calliphoridae. In: Pont A.C., Papp L., Darvas B. & Wood D.M. (eds.), Manual of European/Palaearctic Diptera. Vol. 3: Brachycera: Muscoidea families. Submitted manuscript (1993/1994).
RONDANI C., 1861. Dipterologiae Italicae Prodromus, 4. Parmae.
RONDANI C., 1865. Diptera Italica non vel minus cognita descripta vel annotata observationibus nonnullis additis (Fasc. II). Atti Soc. ital. Sci. nat., Milano, 8: 193-231.
SCHUMANN H., 1964. Revision der gattung Onesia Robineau-Desvoidy, 1830 (Diptera, Calliphoridae). Beitr. Ent., 14: 915-938.
SCHUMANN H., 1974. Revision der palaearktischen Bellardia-Arten (Diptera, Calliphoridae). Dt. ent. Z. (N. F.), 21: 231-299.
SCHUMANN H., 1986. Family Calliphoridae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 12. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 11-58.
SÉGUY E., 1928. Études sur les mouches parasites. Tome l. Conopides, Oestrides et Calliphorines de l'Europe occidentale. Recherches sur la morphologie et la distribution geographique des Diptères à larves parasites. Encycl. ent. (A), 9: 1-251.
TUCCIMEI G., 1911. Saggio di un catalogo dei ditteri della provincia di Roma. Parte III. Boll. Soc. zool ital., 12: 191-227.
ZANGHERI P., 1950. Fauna di Romagna. Ditteri. 2a parte. Mem. Soc. ent. It., Genova, 29: 68-95.
ZANGHERI P., 1969. Repertorio sistematico e topograflco della flora e fauna vivente e fossile della Romagna. Tomo 3. Mem. f. serie Mus. civ. Stor. nat., Verona, 1: 855-1414.
ZUMPT F., 1956. Calliphorinae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, XI, 64i. Schweizerbart, Stuttgart.
SARCOPHAGIDAE
PAPE T., 1988. A revision of the Palaearctic Sarcophagidae (Diptera) described by C. Rondani. Stuttgarter Beiträge zur Naturkunde (Ser. A), 416: 1-22.
SACCÀ G. & RIVOSECCHI L., 1953. Contributo alla conoscenza faunistica del genere Sarcophaga in Italia (Diptera, Calliphoridae). Riv. Parasitol., 14: 37-47. [Pubbl. anche nei Rendiconti dell'Ist. super. di Sanità, Roma 17: 174-187 (1954)]
VENTURI F., 1960. Sistematica e geonemia dei Sarcofagidi (escl. Sarcophaga s.l.) italiani (Diptera). Frustula Entomologica, 2 (7): 1-124.
VERVES Yu.G., 1986. Family Sarcophagidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 12. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 58-193.
RHINOPHORIDAE
CROSSKEY R.W., 1977. A review of Rhinophoridae (Diptera) and a revision of the Afrotropical species. Bull. British Mus. (Nat. Hist.), Entomology, 36: 1-66.
HERTING B., 1961. Rhinophorinae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, IX, 64e. Schweizerbart, Stuttgart.
HERTING B., 1993. Family Rhinophoridae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 13. Hungarian Natural History Museum, Hungary: 102-117.
PAPE T., 1986. A phylogenetic analysis of the woodlouse flies (Diptera: Rhinophoridae). Tijdschr. Entom., 129: 15-34.
PAPE T., 1989. A revision of the Rhinophoridae (Diptera) described by C. Rondani. Ent. scand., 19: 355-358.
WOOD D.M., 1987. Rhinophoridae. In: McAlpine J.F. (ed.), Manual of Nearctic Diptera, 2. Res. Branch Agric. Canada, Monograph 28: 1187-1191.
TACHINIDAE
CAMPADELLI G., 1989. Secondo contributo alla conoscenza della fauna tachinologica di Romagna (Diptera). Boll. Soc. ent. It., 120: 206-208.
CAMPADELLI G. & BARONIO P., 1982. Ditteri Tachinidi di Romagna: nuove segnalazioni. Boll. Ist. Ent. Univ. Bologna, 36: 37-48.
HERTING B., 1960. Biologie der westpaläarktischen Raupenfliegen (Dipt. Tachinidae). Z. ang. Ent., Hamburg Monogr. Beih., 16.
HERTING B., 1983. Phasiinae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, IX, 64c. Schweizerbart, Stuttgart.
HERTING B., 1984. Catalogue of Palearctic Tachinidae (Diptera). Stuttg. Beitr. Naturk. (A) 369: 1-228.
HERTING B. & DELY-DRASKOVITS A., 1993. Family Tachinidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 13. Hungarian Natural History Museum, Hungary: 118-458.
MELLINI E., 1990. Sinossi di biologia dei Ditteri Larvevoridi. Boll. Ist. Ent. Univ. Bologna, 45: 1-38.
MESNIL L.P., 1944-75. Larvaevorinae (Tachininae). In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, X (1), 64g. Schweizerbart, Stuttgart.
MESNIL L.P., 1980. Dexiinae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, IX, 64f. Schweizerbart, Stuttgart.
RONDANI C., 1856-62. Dipterologiae Italicae Prodromus, 1-5. Parmae.
TSCHORSNIG H.P. & HERTING B., 1994. Die Raupenfliegen (Diptera: Tachinidae) Mitteleuropas: Bestimmungstabellen und Angaben zur Verbreitung und Ökologie der einzelnen Arten. Stuttg. Beitr. Naturk. (A), 506: 1-170.
OESTRIDAE (inc. Gasterophilidae)
DI DECO M.A., RUGGERO G., PETRARCA V. & LAURENZA M., 1981 . Un caso umano di miasi da Dermatobia hominis. Parassitologia, 23: 173-175.
GRUNIN,K.J., 1965. Hypodermatidae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, VIII, 64b. Schweizerbart, Stuttgart.
GRUNIN K.J., 1966. Oestridae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region,VIII, 64a'. Schweizerbart, Stutgart.
GRUNIN, K. J., 1969. Gasterophilidae. In: Lindner E. (ed.), Die Fliegen der Palaearktischen Region, VIII, 64a. Schweizerbart, Stuttgart.
SCHOLL P.J., 1993. Biology and control of cattle grubs. Annu. Rev. Entomol., 39: 53-70.
SOÓS Á. & MINÁR J., 1986. Families Gasterophilidae, Oestridae, Hypodermatidae. In: Soós Á. & Papp L. (eds.), Catalogue of Palaearctic Diptera, 11. Akadémiai Kiadó, Budapest - Elsevier, Amsterdam: 237-251.
WOOD D.M., 1987. Oestridae. In: McAlpine J.F. (ed.), Manual of Nearctic Diptera, 2. Res. Branch Agric. Canada, Monograph 28: 1147-1158.
Famiglia Hippoboscidae
001.0. Ornithoica Rondani, 1878
001.0 turdi Latreille, 1811 (=beccariina Rondani, 1878) N S
002.0. Ornithophila Rondani, 1879
001.0 gestroi (Rondani, 1878) Si? Sa
002.0 metallica (Schiner, 1864) (=vagans Rondani, 1897) N S
003.0. Ornithomya Latreille, 1802
001.0 avicularia (Linnaeus, 1758) N S Si Sa
(=Hippobosca corvi Scopoli, 1763)
002.0 biloba (Dufour, 1827) (=fringillina Curtis, 1836 partim) S
003.0 chloropus (Bergroth, 1901) (=fringillina Curtis, 1836 partim) N S
004.0 fringillina (Curtis, 1836) N S Si
004.0. Craterina V. Olfers, 1816
001.0 melbae (Rondani, 1879) N S
002.0 pallida (Olivier in Latreille, 1811) N S Si Sa
005.0. Stenepteryx Leach, 1817 (=Chelidomyia Rondani, 1879)
001.0 hirundinis (Linnaeus, 1758) (=cypseli Rondani, 1879) N S Si Sa
006.0. Icosta Speiser, 1905 (=Olfersia Auct.)
001.0 ardeae (Macquart, 1835) (=botauri Rondani, 1879) N S Si Sa
007.0. Pseudolynchia Bequaert, 1926
001.0 canarinensis (Macquart, 1840) (=falcinelli Rondani, 1879) N S Si Sa
002.0 garzettae (Rondani, 1879) N S
008.0. Hippobosca Linnaeus, 1758
001.0 equina Linnaeus, 1758 (=taurina Rondani, 1879) N S Si Sa
002.0 longipennis Fabricius, 1805 N S Si Sa
009.0. Liptotena Nitzsch, 1818
001.0 cervi (Linnaeus, 1758) N S Si Sa
010.0. Melophagus Latreille, 1802
001.0 ovinus (Linnaeus, 1758) N S Si Sa
002.0 rupicaprinus Rondani, 1879 N
Famiglia Streblidae
011.0. Brachytarsina Macquart, 1851 (=Nycterybosca Speiser, 1900)
001.0 flavipennis Macquart, 1851 S Sa
(=kollari Frauenfeld, 1851 =africana Walker, 1859 partim)
Famiglia Nycteribiidae
012.0. Nycteribia Latreille, 1796
001.0 kolenatii Theodor & Moscona, 1954 N S
002.0 latreilli (Leach, 1817) N S Si Sa
003.0 pedicularia Latreille, 1805 N S Si Sa
004.0 schmidli Schiner, 1853 N S Si Sa
005.0 vexata Westwood, 1835 (=ercolanii Rondani, 1879) N S Si Sa
013.0. Phthiridium Hermann, 1804
001.0 biarticulatum Hermann, 1804 S Sa
014.0. Basilia Miranda Ribeiro, 1903
001.0 italica Theodor, 1954 S
015.0. Penicillidia Kolenati, 1863
001.0 conspicua Speiser, 1901 N S Si Sa
002.0 dufouri (Westwood, 1835) N S Si Sa
Famiglia Calliphoridae
016.0. Bellardia Robineau-Desvoidy, 1863
001.0 bayeri (Jacentkovsky, 1937) S
E 002.0 brevistylata (Villeneuve, 1926) Si
003.0 *obsoleta (Meigen, 1824) S?
(=pruinosa Enderlein, 1933 =clausa Macquart, 1835)
004.0 *pandia (Walker, 1849) N
(=biseta Kramer, 1917 ="hircta" Auct.)
E 005.0 siciliensis (Villeneuve, 1926) Si
006.0 viarum (Robineau-Desvoidy, 1830) (=pusilla Meigen, 1826) N
007.0 vulgaris (Robineau-Desvoidy, 1830) (=agilis Meigen, 1826) N
017.0. Calliphora Robineau-Desvoidy, 1830
(=Steringomyia Pokorny, 1889
=Acrophaga Brauer & Bergenstamm, 1891 =Somomyia Auct.)
E 001.0 bezzi Zumpt, 1956 N
002.0 stelviana (Brauer & Bergenstamm, 1891) (=alpina Auct.) N
E 003.0 stylifera Pokorny, 1889 N
004.0 subalpina (Ringdahl, 1931) (=alpina sensu Bezzi, 1918) N
005.0 *vicina Robineau-Desvoidy, 1830 N S Si Sa
(=erythrocephala Meigen, 1826)
006.0 vomitoria (Linnaeus, 1758) N S Si
018.0. *Cynomya Robineau-Desvoidy, 1830
001.0 mortuorum (Linnaeus, 1761) N S
019.0. Onesia Robineau-Desvoidy, 1830
001.0 austriaca Villeneuve, 1920 N
002.0 *floralis Robineau-Desvoidy, 1830 N S Si
(=sepulcralis Meigen, 1826 nec Linnaeus, 1758
=subapeninna Rondani, 1862 =vespillo Auct.)
020.0. *Chrysomya Robineau-Desvoidy, 1830
(=Compsomyia Rondani, 1875
001.0 albiceps (Wiedemann, 1819) S Si
021.0. Phormia Robineau-Desvoidy, 1830
001.0 regina (Meigen, 1826) (=lucens Rondani, 1862) N S
022.0. Protocalliphora Hough, 1899
001.0 azurea (Fallén, 1817) (=caerulea Robineau-Desvoidy, 1830) N Si
002.0 *chrysorrhoea Meigen, 1826 (=sordida Zetterstedt, 1838) N?
003.0 falcozi Séguy, 1928 N
023.0. Protophormia Townsend, 1908
001.0 *terraenovae (Robineau-Desvoidy, 1830) N S
024.0. Eurychaeta Brauer & Bergenstamm, 1891
(=Theria Robineau-Desvoidy, 1830 =Helicobosca Bezzi, 1906)
001.0 muscaria (Meigen, 1826) N S
002.0 palpalis (Robineau-Desvoidy, 1830) N
025.0. Lucilia Robineau-Desvoidy, 1830
(=Phaenicia Robineau-Desvoidy, 1863)
001.0 ampullacea Villeneuve, 1922 N S
002.0 *caesar (Linnaeus, 1758) N S Si
003.0 richardsi Collin, 1926 N S
004.0 sericata (Meigen, 1826) N S Si
005.0 *silvarum (Meigen, 1826) N S
026.0. Angioneura Brauer & Bergenstamm, 1893
001.0 acerba (Meigen, 1838) (=pygmaea Zetterstedt, 1844) N
027.0. *Eggisops Rondani, 1862
001.0 pecchiolii Rondani, 1862 N S
028.0. Melanomya Rondani, 1856
001.0 nana (Meigen, 1826) N
029.0. Melinda Robinea-Desvoidy, 1830
001.0 gentilis (Robineau-Desvoidy, 1830) S
002.0 *viridicyanea (Robineau-Desvoidy, 1830) N S Si
(=cognata Auct. nec Meigen =coerulea Auct. nec Meigen)
030.0. Morinia Robineau-Desvoidy, 1830
(=Anthracomya Rondani, 1856)
001.0 melanoptera (Fallén, 1817) N
(=geneji Rondani, 1856 =genei Rondani, 1862)
031.0. Pollenia Robineau-Desvoidy, 1830
(=Nitellia Robineau-Desvoidy, 1830 =Micronitellia Lehrer, 1967)
001.0 amentaria (Scopoli, 1763) (=vespillo Auct. nec Fabricius) N S Si
002.0 angustigena Wainwright, 1940 N S
003.0 atramentaria (Meigen, 1826) (=levis Rondani, 1862) N
E 004.0 bezziana Rognes, 1991 N
005.0 contempta Robineau-Desvoidy, 1863 S
006.0 dasypoda Portschinsky, 1881 N
007.0 griseotomentosa (Jacentkovsky, 1944) N S
(=varia Auct. nec Meigen)
008.0 hungarica Rognes, 1987 N
009.0 labialis Robineau-Desvoidy, 1863 N
(=intermedia Auct. nec Macquart)
010.0 mediterranea Grunin, 1966 N S
011.0 paupera Rondani, 1862 (=longitheca Rognes, 1987) S Si Sa
012.0 pediculata Macquart, 1834 (=pseudorudis Rognes, 1985) N S
013.0 ponti Rognes, 1991 S
014.0 rudis (Fabricius, 1794) N Si
015.0 ruificrura Rondani, 1862 N
016.0 vagabunda (Meigen, 1826) (=pulvillata Rondani, 1862) N
017.0 venturii Zumpt, 1956 S
018.0 viatica Robineau-Desvoidy, 1830 N
(=pallida Rohdendorf, 1926)
032.0. Cosmina Robineau-Desvoidy, 1830
001.0 prasina (Brauer & Bergenstamm, 1889) Si
033.0. *Rhyncomya Robineau-Desvoidy, 1830
001.0 *columbina (Meigen, 1824) S Si
002.0 felina (Fabricius, 1794) (=ruficeps Fabricius, 1805) N S Si
003.0 impavida (Rossi, 1790) S Si Sa
(=punctata O.G. Costa, 1835 =audax Rondani, 1861)
004.0 italica Bezzi, 1911 Sa
034.0. *Stomorhina Rondani, 1861 (=Idia Wiedermann, 1820)
001.0 lunata (Fabricius, 1805) N S Si Sa
(=fasciata Meigen, 1826 =macuata Rondani, 1865)
Famiglia Sarcophagidae
035.0. Amobia Robinaeu-Desvoidy, 1830
001.0 oculata (Zetterstedt, 1844) N
002.0 pelopei (Rondani, 1859) N S
003.0 signata (Meigen, 1824) N S Si Sa
036.0. Apodacra Macquart, 1854
001.0 diffusa Villeneuve, 1934 S
002.0 dispar Villeneuve, 1916 N
003.0 pulchra Egger, 1861 S
004.0 seriemaculata Macquart, 1854 N S
037.0. Craticulina Bezzi, 1906
001.0 tabaniformis (Fabricius, 1805) S Si Sa
038.0. Hilarella Rondani, 1856
001.0 hilarella (Zetterstedt, 1844) N S
002.0 stictica (Meigen, 1830) N
039.0. Macronychia Rondani, 1859
001.0 agrestis (Fallén, 1810) Sa
002.0 alpestris Rondani, 1865 N
003.0 kanoi Kurahashi, 1972 N
004.0 polyodon (Meigen, 1824) N S
005.0 striginervis (Zetterstedt, 1844) N
040.0. Metopia Meigen, 1803
001.0 argyrocephala (Meigen, 1824) N S Si
002.0 campestris (Fallén, 1810) N S
003.0 grandii Venturi, 1953 N S
004.0 italiana Pape, 1985 N S
005.0 roserii Rondani, 1859 S Si
041.0. Metopodia Brauer & Bergenstamm, 1889
001.0 pilicornis (Pandellé, 1895) Sa
042.0. Miltogramma Meigen, 1803
001.0 aurifrons Dufour, 1850 N S
002.0 brevipilum Villeneuve, 1911 N S
003.0 contarinii Rondani, 1859 N S
004.0 ibericum Villeneuve, 1912 N
005.0 germari Meigen, 1824 N
006.0 murinum Meigen, 1824 N S Si Sa
007.0 occipitale Pandellé, 1895 N
008.0 oestraceum (Fallén, 1820) N S
009.0 punctatum Meigen, 1824 N S Si Sa
010.0 ruficorne Meigen, 1824 N
011.0 rutilans Meigen, 1824 N S Sa
012.0 taeniatum Meigen, 1824 N S
013.0 testaceifrons (Roser, 1840) N
014.0 villeneuvei Verves, 1982 N
043.0. Oebalia Robineau-Desvoidy, 1863
001.0 cylindrica (Fallén, 1810) N S
002.0 minuta (Fallén, 1810) N
044.0. Phrosinella Robineau-Desvoidy, 1863
001.0 nasuta (Wiedemann, 1824) N S
045.0. Phylloteles Loew, 1844
001.0 pictipennis Loew, 1844 N S Si
046.0. Protomiltogramma Townsend, 1916
001.0 fasciata (Meigen, 1824) N S
047.0. Pterella Robineau-Desvoidy, 1863
E 001.0 eleonorae (Venturi, 1957) S
002.0 grisea (Meigen, 1824) N S
003.0 melanura (Meigen, 1824) N S Si Sa
004.0 penicillaris (Rondani, 1865) N S
048.0. Senotainia Macquart 1846
001.0 albifrons (Rondani, 1859) N S Si
002.0 conica (Fallén, 1810) N S
003.0 tricuspis (Meigen, 1838) N S Si
049.0. Sphenometopa Townsend, 1908
001.0 fastuosa (Meigen, 1824) N S
002.0 stelviana (Brauer & Bergenstamm, 1891) N
050.0. Taxigramma Perris, 1852
001.0 *elegantulum (Zetterstedt, 1844)
002.0 heteroneurum (Meigen, 1830) S
003.0 multipunctatum (Rondani, 1859) N S Si
004.0 pluriseta (Pandellé, 1895) N
005.0 pseudapertum Séguy, 1941 S
051.0. Agria Robineau-Desvoidy, 1830
001.0 affinis (Fallén, 1817) N S Sa
002.0 mamillata (Pandellé, 1896) N
052.0. Angiometopa Brauer & Bergenstamm, 1889
001.0 falleni Pape, 1986 N S Si
053.0. Brachicoma Rondani, 1856
001.0 devia (Fallén, 1820) N S
054.0. Nyctia Robineau-Desvoidy, 1830
001.0 halterata (Panzer, 1798) N S Si
055.0. Paramacronychia Brauer & Bergenstamm, 1889
001.0 flavipalpis (Girschner, 1881) N S
056.0. Sarcophila Rondani, 1856
001.0 latifrons (Fallén, 1817) N S Si
002.0 *meridionalis Verves, 1982
057.0. Wohlfahrtia Brauer & Bergenstamm, 1889
001.0 magnifica (Schiner, 1862) S
002.0 vigil (Walker, 1849) S
058.0. Blaesoxipha Loew, 1861 subg. Acridiophaga Townsend, 1917
001.0 fossoria (Pandellé, 1896) N
059.0. Blaesoxipha Loew, 1861 subg. Blaesoxipha Loew, 1861
001.0 agrestis (Robineau-Desvoidy, 1863) N S Sa
002.0 cochlearis (Pandellé, 1896) N
003.0 laticornis (Meigen, 1826) N
004.0 *litoralis (Villeneuve, 1911)
005.0 *occatrix (Pandellé, 1896)
006.0 pandellei (Villeneuve, 1911) Si
007.0 plumicornis (Zetterstedt, 1859) S
008.0 pygmaea (Zetterstedt, 1844) N
009.0 redempta (Pandelllé, 1896) N
010.0 rufipes (Macquart, 1839) N S
011.0 ungulata (Pandellé, 1896) N
060.0. Blaesoxipha Loew, 1861
subg. Servaisia Robineau-Desvoidy, 1863
001.0 erythrura (Meigen, 1826) N S
002.0 rossica Villeneuve, 1912 N
061.0. Blaesoxipha Loew, 1861
subg. Tephromyia Robineau-Desvoidy, 1830
001.0 grisea (Meigen, 1826) S
062.0. Ravinia Robineau-Desvoidy, 1863
001.0 pernix (Harris, 1780) N S Si Sa
063.0. Sarcophaga Meigen, 1826
subg. Bellieriomima Rohdendorf, 1937
001.0 subulata Pandellé, 1896 N S
064.0. Sarcophaga Meigen, 1826
subg. Bercaea Robineau-Desvoidy, 1863
001.0 cruentata Meigen, 1826 N S Si Sa
065.0. Sarcophaga Meigen, 1826
subg. Discachaeta Enderlein, 1928
001.0 arcipes Pandellé, 1896 N
002.0 cucullans Pandellé, 1896 N S
003.0 cultellata Pandellé, 1896 N S
004.0 pumila Meigen, 1826
066.0. Sarcophaga Meigen, 1826
subg. Helicophagella Enderlein, 1928
001.0 agnata Rondani, 1860 N S Si
002.0 crassimargo Pandellé, 1896 S
003.0 hirticrus Pandellé, 1896 N S
004.0 maculata Meigen, 1835 S
005.0 melanura Meigen, 1826 N S Si Sa
006.0 noverca Rondani, 1860 N S
007.0 novercoides Boettcher, 1913 N S Si Sa
008.0 okaliana (Lehrer, 1975) (=cepelaki Lehrer, 1975) N
009.0 rosellei Boettcher, 1912 S Si
067.0. Sarcophaga Meigen, 1826
subg. Heteronychia Brauer & Bergenstamm, 1889
001.0 amita Rondani, 1860 N S
002.0 ancilla Rondani, 1865 N S
003.0 balanina Pandellé, 1896 N S
004.0 benaci Boettcher, 1913 N
005.0 bezziana Boettcher, 1913 N S
006.0 boettcheriana (Rohdendorf, 1937) S
007.0 consanguinea Rondani, 1860 N S Si
008.0 depressifrons Zetterstedt, 1845 N
009.0 dissimilis Meigen, 1826 S
010.0 ferox Villeneuve, 1908 S Si
011.0 fertoni Villeneuve, 1911 S Si
012.0 filia Rondani, 1860 N S
013.0 haemorrhoa Meigen, 1826 N S Si
014.0 haemorrhoides Boettcher, 1913 N S
015.0 minima Rondani, 1826 N S Si
016.0 monspellencia Boettcher, 1913 S
017.0 pandellei (Rohdendorf, 1937) N S Si
018.0 penicillata Villeneuve, 1907 N S Si
019.0 porrecta Boettcher, 1913 N
020.0 proxima Rondani, 1860 N S
021.0 rondaniana (Rohdendorf, 1937) N
022.0 schineri Bezzi, 1891 N
023.0 schnabli Villeneuve, 1911 S Si
024.0 setinervis Rondani, 1860 N S
E 025.0 siciliana (Enderlein, 1928) Si
E 026.0 *siciliana (Rohdendorf, 1937) Si
027.0 siciliensis Boettcher, 1913 Si
028.0 *strenua (Robineau-Desvoidy, 1863)
029.0 tenuiforceps Boettcher, 1913 N
030.0 uncicurva Pandellé, 1896 N S Si
031.0 vagans Meigen, 1826 N S
032.0 vicina Macquart, 1835 N S
068.0. Sarcophaga Meigen, 1826 subg. Krameromyia Verves, 1982
001.0 anaces Walker, 1849 N S
069.0. Sarcophaga Meigen, 1826 subg. Liopygia Enderlein, 1928
001.0 argyrostoma (Robineau-Desvoidy, 1830) N S Si
002.0 crassipalpis Macquart, 1839 N S Si Sa
070.0. Sarcophaga Meigen, 1826
subg. Liosarcophaga Enderlein, 1928
001.0 dux Thomson, 1869 (=exuberans Pandellé, 1896) N S Si Sa
002.0 marshalli Parker, 1923 S
003.0 portschinskyi (Rohdendorf, 1937) Sa
004.0 teretirostris Pandellé, 1896 N S Si Sa
005.0 tibialis Macquart, 1851 N S Si Sa
006.0 tuberosa Pandellé, 1896 S Sa
071.0. Sarcophaga Meigen, 1826 subg. Mehria Enderlein, 1928
001.0 sexpunctata (Fabricius, 1805) N S
072.0. Sarcophaga Meigen, 1826
subg. Mimarhopocnemis Rohdendorf, 1937
001.0 granulata Kramer, 1908 N
073.0. Sarcophaga Meigen, 1826 subg. Pandelleana Rohdendorf, 1937
001.0 protuberans Pandellé, 1896 N S Si
074.0. Sarcophaga Meigen, 1826 subg. Pandelleisca Rohdendorf, 1937
001.0 similis Meade, 1876 N S
075.0. Sarcophaga Meigen 1826
subg. Parasarcophaga Johnston & Tiegs, 1921
001.0 albiceps Meigen, 1826 N S Si
076.0. Sarcophaga Meigen, 1826
subg. Pierretia Robineau-Desvoidy, 1863
001.0 discifera Pandellé, 1896 S
002.0 nigriventris Meigen, 1826 N S Si Sa
003.0 socrus Rondani, 1860 N S Si
004.0 soror Rondani, 1860 N S
005.0 *villeneuvei Boettcher, 1912
077.0. Sarcophaga Meigen, 1826
subg. Pseudothyrsocnema Rohdendorf, 1937
001.0 spinosa Villeneuve, 1911 N
078.0. Sarcophaga Meigen, 1826 subg. Robineauella Enderlein, 1928
001.0 caerulescens Zetterstedt, 1838 N S
079.0. Sarcophaga Meigen, 1826 subg. Rosellea Rohdendorf, 1937
001.0 aratrix Pandellé, 1896 N S
080.0. Sarcophaga Meigen, 1826 subg. Sarcophaga Meigen, 1826
001.0 carnaria (Linnaeus, 1758) (=schulzi Müller, 1922)
002.0 jeanleclercqi Lehrer, 1975 N
003.0 lehmanni Müller, 1922 N S
004.0 subvicina Rohdendorf, 1937 Si
005.0 variegata (Scopoli, 1763) N S
081.0. Sarcophaga Meigen, 1826
subg. Sarcotachinella Townsend, 1892
001.0 sinuata Meigen, 1826 N S
082.0. Sarcophaga Meigen, 1826 subg. Thyrsocnema Enderlein, 1928
001.0 corsicana Villeneuve, 1911 Sa
002.0 incisilobata Pandellé, 1896 N S Si
083.0. Sarcophaga Meigen, 1826 subg. Varirosellea Xue, 1979
001.0 uliginosa Kramer, 1908 S Sa
Famiglia Rhinophoridae
084.0. Macrotarsina Schiner, 1857
001.0 longimana (Egger, 1856) N
085.0. Melanophora Meigen, 1803
001.0 roralis (Linnaeus, 1758) N S
086.0. Oplisa Rondani, 1862
001.0 tergestina (Schiner, 1862) N S
087.0. Paykullia Robineau-Desvoidy, 1830
001.0 maculata (Fallén, 1820) S
002.0 nubilipennis (Loew, 1847) N S Si
003.0 partenopea (Rondani, 1860) N S
088.0. Phyto Robineau-Desvoidy, 1830
001.0 adolescens Rondani, 1860 N S Si
002.0 angustifrons (Rondani, 1856) N
003.0 brevipila Herting, 1961 N
004.0 celer (Rondani, 1862) N S
005.0 cingulata (Zetterstedt, 1844) N
006.0 melanocephala (Meigen, 1824) N
089.0. Rhinomorinia Brauer & Bergenstamm, 1889
001.0 sarcophagina Schiner, 1862 N S
002.0 subrostrata Villeneuve, 1913 N
090.0. Rhinophora Robineau-Desvoidy, 1830
001.0 lepida (Meigen, 1824) N
091.0. Stevenia Robineau-Desvoidy, 1830
001.0 atramentaria (Meigen, 1824) N S
002.0 deceptoria (Loew, 1847) N S Si Sa
003.0 obscuripennis (Loew, 1847) N S
004.0 signata (Mik, 1866) N
005.0 umbratica (Fallén, 1820) N S Si
092.0. Tricogena Rondani, 1856
001.0 rubricosa (Meigen, 1824) N
093.0. Tromodesia Rondani, 1856
001.0 vibripennis Rondani, 1856 N
Famiglia Tachinidae
094.0. Exorista Meigen, 1803 subg. Exorista Meigen, 1803
001.0 fasciata (Fallén, 1820) N
002.0 larvarum (Linné, 1758) N S Sa
003.0 segregata (Rondani, 1859) N Si Sa
095.0. Exorista Meigen, 1803 subg. Exoristella Mesnil, 1946
001.0 glossatorum (Rondani, 1859) N
096.0. Exorista Meigen, 1803
subg. Podotachina Brauer & Bergenstamm, 1891
001.0 grandis (Zetterstedt, 1844) N
002.0 sorbillans (Wiedemann, 1830) N S
097.0. Exorista Meigen, 1803 subg. Tricholyga Rondani, 1856
001.0 nova (Rondani, 1859) N
098.0. Exorista Meigen, 1803
subg. Ptilotachina Brauer & Bergenstamm, 1891
001.0 civilis (Rondani, 1859) N S
002.0 florentina Herting, 1975 N
003.0 xanthaspis (Wiedemann, 1830) S
099.0. Exorista Meigen, 1803 subg. Adenia Robineau-Desvoidy, 1863
001.0 mimula (Meigen, 1824) N S
002.0 nympharum (Rondani, 1859) N
003.0 rustica Fallén, 1810) N S
100.0. Neophryxe Townsend, 1916
001.0 vallina (Rondani, 1861) N
101.0. Chetogena Rondani, 1856
001.0 acuminata Rondani, 1859 N S
002.0 fasciata (Egger, 1856) Si
003.0 filipalpis Rondani, 1859 N
004.0 media Rondani, 1859 N
005.0 obliquata (Fallén, 1810) N S
006.0 rondaniana (Villeneuve, 1931) N S
007.0 siciliensis (Villeneuve, 1924) Si
102.0. Parasetigena Brauer & Bergenstamm, 1891
001.0 silvestris (Robineau-Desvoidy, 1863) N
103.0. Phorocera Robineau-Desvoidy, 1830
001.0 assimilis Fallén, 1810) N
002.0 grandis (Rondani, 1859) N
003.0 obscura (Fallén, 1810) N
104.0. Phorinia Robineau-Desvoidy, 1830
001.0 aurifrons Robineau-Desvoidy, 1830 N S
105.0. Bessa Robineau-Desvoidy, 1863
001.0 parallela (Meigen, 1824) N S
002.0 selecta (Meigen, 1824) N
106.0. Belida Robineau-Desvoidy, 1863
001.0 angelicae (Meigen, 1824) N S
107.0. Meigenia Robineau-Desvoidy, 1830
001.0 dorsalis (Meigen, 1824) N S
002.0 majuscula (Rondani, 1859) N S
003.0 mutabilis (Fallén, 1810) N S
004.0 uncinata Mesnil, 1967 N
108.0. Conogaster Brauer & Bergenstamm, 1891
001.0 pruinosa (Meigen, 1824) N
109.0. Zaira Robineau-Desvoidy, 1830
001.0 cinerea (Fallén, 1810) N Sa
110.0. Gastrolepta Rondani, 1862
001.0 anthracina (Meigen, 1826) N
111.0. Trigonospila Pokorny, 1886
001.0 ludio (Zetterstedt, 1849) N
112.0. Medina Robineau-Desvoidy, 1830
001.0 collaris (Fallén, 1820) N S
002.0 luctuosa (Meigen, 1824) N
003.0 melania (Meigen, 1824) N
004.0 separata (Meigen, 1824) N
113.0. Policheta Rondani, 1856
001.0 unicolor (Fallén, 1820) N
114.0. Istocheta Rondani, 1859
001.0 cinerea (Macquart, 1850) N
002.0 hemichaeta (Brauer & Bergenstamm, 1889) N Si
115.0. Staurochaeta Brauer & Bergenstamm, 1889
001.0 albocingulata (Fallén, 1820) N
116.0. Lecanipa Rondani, 1859
001.0 leucomelas (Meigen, 1824) N S
117.0. Leiophora Robineau-Desvoidy, 1863
001.0 innoxia (Meigen, 1824) N
118.0. Admontia Brauer & Bergenstamm, 1889
001.0 blanda (Fallén, 1820) N
002.0 grandicornis (Zetterstedt, 1849) N
003.0 maculisquama (Zetterstedt, 1859) N
119.0. Oswaldia Robineau-Desvoidy, 1863
001.0 spectabilis (Meigen, 1824) N S
120.0. Lomachantha Rondani, 1859
001.0 parra Rondani, 1859 N S
121.0. Ligeria Robineau-Desvoidy, 1863
001.0 angusticornis (Loew, 1847) N S Si
122.0. Erynniopsis Townsend, 1926
001.0 antennata (Rondani, 1861) N
123.0. Ligeriella Mesnil, 1961 N
001.0 aristata (Villeneuve, 1911)
124.0. Blondelia Robineau-Desvoidy, 1830
001.0 nigripes (Fallén, 1810) N S
125.0. Compsilura Bouché, 1834
001.0 concinnata (Meigen, 1824) N S Sa
126.0. Vibrissina Rondani, 1861
001.0 turrita (Meigen, 1824) N
127.0. Acemya Robineau-Desvoidy, 1830
001.0 acuticornis (Meigen, 1824) N S
002.0 rufitibia (von Roser, 1840) N
128.0. Ceracia Rondani, 1865
001.0 mucronifera Rondani, 1865 N
129.0. Thrixion Brauer & Bergenstamm, 1889
001.0 aberrans (Schiner, 1862) S Si
130.0. Ethilla Robineau-Desvoidy, 1863
001.0 aemula (Meigen, 1824) N
131.0. Paratryphera Brauer & Bergenstamm, 1891
001.0 barbatula (Rondani, 1859) N
002.0 bisetosa (Brauer & Bergenstamm, 1891) N
003.0 palpalis (Rondani, 1859) N S
132.0. Atylomyia Brauer, 1898
001.0 loewi Brauer, 1898 N S
133.0. Smidtia Robineau-Desvoidy, 1830
001.0 conspersa (Meigen, 1824) N
134.0. Timavia Robnineau-Desvoidy, 1863
001.0 amoena (Meigen, 1824) N
135.0. Winthemia Robineau-Desvoidy, 1830
001.0 bohemani (Zetterstedt, 1844) N
002.0 cruentata (Rondani, 1859) N
003.0 quadripustulata (Fabricius, 1794) N
004.0 rufiventris (Macquart, 1849) N
005.0 speciosa (Egger, 1861) N
006.0 venusta (Meigen, 1824) N
136.0. Nemorilla Rondani, 1856
001.0 floralis (Fallén, 1810) N S
002.0 maculosa (Meigen, 1824) N S
137.0. Aplomya Robineau-Desvoidy, 1830
001.0 confinis (Fallén, 1820) N S Sa
138.0. Phebellia Robineau-Desvoidy, 1846
001.0 glauca (Meigen, 1824) N S
002.0 glirina (Rondani, 1859) N
003.0 nigripalpis (Robineau-Desvoidy, 1847) N
004.0 pauciseta (Villeneuve, 1908) N
005.0 stulta (Zetterstedt, 1844) N
139.0. Ptesiomyia Brauer & Bergenstamm, 1893
001.0 alacris (Meigen, 1824) N S
140.0. Nilea Robineau-Desvoidy, 1863
001.0 hortulana (Meigen, 1824) N
002.0 innoxia Robineau-Desvoidy, 1863 N S
141.0. Phonomyia Brauer & Bergenstamm, 1893
001.0 aristata (Rondani, 1861) N
142.0. Tlephusa Robineau-Desvoidy, 1863
001.0 cincinna (Rondani, 1859) N S
143.0. Epicampocera Macquart, 1849
001.0 succincta (Meigen, 1824) N S
144.0. Buquetia Robineau-Desvoidy, 1847
001.0 musca Robineau-Desvoidy, 1847 N
145.0. Phryxe Robineau-Desvoidy, 1830
001.0 caudata (Rondani, 1859) N S
002.0 erythrostoma (Hartig, 1838) N
003.0 magnicornis Zetterstedt, 1838 N
004.0 nemea (Meigen, 1824) N Sa
005.0 semicaudata Herting, 1959 S
006.0 setifacies (Villeneuve, 1910) N
007.0 vulgaris (Fallén, 1810) N S
146.0. Gymnophryxe Villeneuve, 1922
001.0 carthaginiensis (Bischof, 1900) Si
147.0. Periarchiolops Villeneuve, 1924
001.0 scutellaris (Fallén, 1820) N
148.0. Bactromyia Brauer & Bergenstamm, 1891
001.0 aurulenta (Meigen, 1824) S
149.0. Pseudoperichaeta Brauer & Bergenstamm, 1889
001.0 nigrolineata (Walker, 1853) N S
002.0 palesoidea (Robineau-Desvoidy, 1830) N
150.0. Catagonia Brauer & Bergenstamm, 1891
001.0 aberrans (Rondani, 1859) N S
151.0. Lydella Robineau-Desvoidy, 1830
001.0 grisescens Robineau-Desvoidy, 1830 N
002.0 stabulans (Meigen, 1824) N Si Sa
003.0 thompsoni Herting, 1959 N
152.0. Chetina Rondani, 1856
001.0 setigena Rondani, 1856 N
153.0. Cadurciella Villeneuve, 1927
001.0 tritaeniata (Rondani, 1859) N
154.0. Drino Robineau-Desvoidy, 1863
001.0 atropivora (Robineau-Desvoidy, 1830) N S
002.0 imberbis (Wiedemann, 1830) N
003.0 inconspicua (Meigen, 1830) N S
004.0 lota (Meigen, 1824) N
005.0 vicina (Zetterstedt, 1849) N
155.0. Thelyconychia Brauer & Bergenstamm, 1889
001.0 solivaga (Rondani, 1861) N
156.0. Amelibaea Mesnil, 1955
001.0 tultschensis (Brauer & Bergenstamm, 1891) N
157.0. Hubneria Robineau-Desvoidy, 1847
001.0 affinis (Fallén, 1810) N
158.0. Tryphera Meigen, 1838
001.0 lugubris (Meigen, 1824) N
159.0. Carcelia Robineau-Desvoidy, 1830
subg. Carcelia Robineau-Desvoidy, 1830
001.0 alpestris Herting, 1966 N
002.0 atricosta Herting, 1961 N
003.0 bombylans Robineau-Desvoidy, 1830 N
004.0 dubia (Brauer & Bergenstamm, 1891) S
005.0 gnava (Meigen, 1824) N
006.0 laxifrons Villeneuve, 1912 Sa
007.0 lucorum (Meigen, 1824) N S Si
008.0 rasa (Macquart, 1849) N
009.0 rasella Baranov, 1931 N
160.0. Carcelia Robineau-Desvoidy, 1830
subg. Euryclea Robineau-Desvoidy, 1863
001.0 falenaria (Rondani, 1859) N S Si
002.0 tibialis (Robineau-Desvoidy, 1863) N
161.0. Senometopia Macquart, 1834
001.0 confundens (Rondani, 1859) N
002.0 excisa (Fallén, 1820) N
003.0 separata (Rondani, 1859) N S
004.0 susurrans (Rondani, 1859) N S
162.0. Thecocarcelia Townsend, 1933
001.0 acutangulata (Macquart, 1850) N S
163.0. Erycia Robineau-Desvoidy, 1830
001.0 fasciata Villeneuve, 1924 N
002.0 fatua (Meigen, 1824) N
003.0 festinans (Meigen, 1824) S
164.0. Erycesta Herting, 1967
001.0 caudigera (Rondani, 1861) N
165.0. Cestonia Rondani, 1861
001.0 cineraria Rondani, 1861 N Sa
166.0. Xylotachina Brauer & Bergenstamm, 1891
001.0 diluta (Meigen, 1824) N
167.0. Alsomyia Brauer & Bergenstamm, 1891
001.0 capillata (Rondani, 1859) N S
168.0. Townsendiellomyia Baranov, 1932
001.0 nidicola (Townsend, 1908) N Sa
169.0. Platymya Robineau-Desvoidy, 1830
001.0 antennata (Brauer & Bergenstamm, 1891) N
002.0 fimbriata (Meigen, 1824) N
170.0 Eumea Robineau-Desvoidy, 1863
001.0 linearicornis (Zetterstedt, 1844) N
002.0 mitis (Meigen, 1824) N
171.0. Myxexoristops Townsend, 1911
001.0 bonsdorffi (Zetterstedt, 1859) N
172.0. Zenillia Robineau-Desvoidy, 1830
001.0 dolosa (Meigen, 1824) N
002.0 libatrix (Panzer, 1798) N
173.0. Clemelis Robineau-Desvoidy, 1863
001.0 apicalis (Villeneuve, 1923) N
002.0 pullata (Meigen, 1824) N
174.0. Pales Robineau-Desvoidy, 1830
001.0 pavida (Meigen, 1824) N S Sa
002.0 processioneae (Ratzeburg, 1840) N S
003.0 pumicata (Meigen, 1824) N Sa
175.0. Phryno Robineau-Desvoidy, 1830
001.0 vetula (Meigen, 1824) N
176.0. Cyzenis Robineau-Desvoidy, 1863
001.0 albicans (Fallén, 1810) N
002.0 jucunda (Meigen, 1838) N S
177.0. Bothria Rondani, 1856
001.0 frontosa (Meigen, 1824) N
002.0 subalpina Villeneuve, 1910 N
178.0. Ceromasia Rondani, 1856
001.0 rubrifrons (Macquart, 1834) N S
179.0. Allophorocera Hendel, 1901
001.0 ferruginea (Meigen, 1824) N
002.0 pachystyla (Macquart, 1850) N
003.0 rutila (Meigen, 1824) N
180.0. Ocytata Gistel, 1848
001.0 pallipes (Fallén, 1820) N S
181.0 Pexopsis Brauer & Bergenstamm, 1889
001.0 aprica (Meigen, 1824) N
182.0. Cadurcia Villeneuve, 1926
001.0 casta (Rondani, 1861) N Sa
183.0. Eurysthaea Robineau-Desvoidy, 1863
001.0 scutellaris (Robineau-Desvoidy, 1848) N S
184.0. Erynnia Robineau-Desvoidy, 1830
001.0 ocypterata (Fallén, 1810) N
185.0. Elodia Robineau-Desvoidy, 1863
001.0 ambulatoria (Meigen, 1824) S
002.0 morio (Fallén, 1820) N Si Sa
186.0. Sturmia Robineau-Desvoidy, 1830
001.0 bella (Meigen, 1824) N S
187.0. Blepharipa Rondani, 1856
001.0 pratensis (Meigen, 1824) N S Sa
188.0. Masicera Macquart, 1834
001.0 pavoniae (Robineau-Desvoidy, 1830) N
002.0 silvatica (Fallén, 1810) N S
003.0 sphingivora (Robineau-Desvoidy, 1830) N S Sa
189.0. Dolichocolon Brauer & Bergenstamm, 1889
001.0 paradoxum Brauer & Bergenstamm, 1889 S
190.0. Prosopea Rondani, 1861
001.0 nigricans (Egger, 1861) N S
191.0. Gaedia Meigen, 1838
001.0 connexa (Meigen, 1824) N S
002.0 distincta Egger, 1861 N
003.0 hispanica Mesnil, 1953 N
192.0. Frontina Meigen, 1838
001.0 laeta (Meigen, 1824) N
193.0. Thelymorpha Brauer & Bergenstamm, 1889
001.0 marmorata (Fabricius, 1805) N
194.0. Baumhaueria Meigen, 1838
001.0 goniaeformis (Meigen, 1824) N
002.0 microps Mesnil, 1963 N
195.0. Pachystylum Macquart, 1848
001.0 bremii Macquart, 1848 N S
196.0. Brachicheta Rondani, 1861
001.0 strigata (Meigen, 1824) N
197.0. Masistylum Brauer & Bergenstamm, 1893
001.0 arcuatum (Mik, 1863) N
198.0. Gonia Meigen, 1803
001.0 atra Meigen, 1826 Si
002.0 bimaculata Wiedemann, 1819 N S Sa
003.0 capitata (DeGeer, 1776) N
004.0 distinguenda Herting, 1963 N
005.0 divisa Meigen, 1826 N
006.0 foersteri Meigen, 1838 N
007.0 ornata Meigen, 1826 N
008.0 picea (Robineau-Desvoidy, 1830) N
199.0. Onychogonia Brauer & Bergenstamm, 1889
001.0 flaviceps (Zetterstedt, 1838) N
200.0. Pseudogonia Brauer & Bergenstamm, 1889
001.0 parisiaca (Robineau-Desvoidy, 1851) N S
002.0 rufifrons (Wiedemann, 1830) N S
201.0. Spallanzania Robineau-Desvoidy, 1830
001.0 hebes (Fallén, 1820) N S
002.0 multisetosa (Rondani, 1859) N
003.0 quadrimaculata Herting, 1967 N
004.0 rectistylum (Macquart, 1847) N Sa
202.0. Tachina Meigen, 1803 subg. Tachina Meigen, 1803
001.0 grossa (Linnaeus, 1758) S
002.0 magna (Giglio-Tos, 1890) N
203.0. Tachina Meigen, 1803 subg. Eudoromyia Bezzi, 1906
001.0 casta (Rondani, 1859) N S Si
002.0 fera (Linnaeus, 1761) N S Si
003.0 magnicornis (Zetterstedt, 1844) N S
004.0 nupta (Rondani, 1859) N S
204.0. Tachina Meigen, 1803 subg. Servillia Robineau-Desvoidy, 1830
001.0 lurida (Fabricius, 1781) N
002.0 ursina Meigen, 1824 N
205.0. Tachina Meigen, 1803 subg. Echinogaster Lioy, 1864
001.0 praeceps Meigen, 1824 N S Si Sa
206.0. Schineria Rondani, 1857
001.0 tergestina Rondani, 1859 N
207.0. Nowickia Wachtl, 1894 subg. Nowickia Wachtl, 1894
001.0 marklini (Zetterstedt, 1838) N
208.0. Nowickia Wachtl, 1894 subg. Fabriciella Bezzi, 1906
001.0 atripalpis (Robineau-Desvoidy, 1863) N S
002.0 ferox (Panzer, 1809) N S
003.0 reducta Mesnil, 1970 N
004.0 rondanii (Giglio-Tos, 1890) N
209.0. Peleteria Robineau-Desvoidy, 1830
001.0 abdominalis Robineau-Desvoidy, 1830 Si
002.0 ferina (Zetterstedt, 1844) N
003.0 meridionalis (Robineau-Desvoidy, 1830) N S
004.0 popelii (Portschinsky, 1882) N
005.0 prompta (Meigen, 1824) N
006.0 rubescens (Robineau-Desvoidy, 1830) N S
007.0 ruficornis (Macquart, 1835) N S
008.0 sphyricera (Macquart, 1835) N
009.0 varia (Fabricius, 1794) N S
210.0. Sarromyia Pokorny, 1893
001.0 nubigena Pokorny, 1893 N
211.0. Germaria Robineau-Desvoidy, 1830
001.0 ruficeps (Fallén, 1820) N
212.0. Nemoraea Robineau-Desvoidy, 1830
001.0 pellucida (Meigen, 1824) N S
213.0. Linnaemya Robineau-Desvoidy, 1830
subg. Linnaemya Robineau-Desvoidy, 1830
001.0 comta (Fallén, 1810) N
002.0 vulpina (Fallén, 1810) N S
214.0. Linnaemya Robineau-Desvoidy, 1830
subg. Bonellimyia Townsend, 1919
001.0 impudica (Rondani, 1859) N
002.0 tessellans (Robineau-Desvoidy, 1830) N
215.0. Linnaemya Robineau-Desvoidy, 1830
subg. Ophina Robineau-Desvoidy, 1863
001.0 fissiglobula Pandellé, 1895 N
002.0 haemorrhoidalis (Fallén, 1810) N S
003.0 media Zimin, 1954 N
004.0 olsufjevi Zimin, 1954 N
005.0 perinealis Pandellé, 1895 N
006.0 picta (Meigen, 1824) N S
216.0. Linnaemya Robineau-Desvoidy, 1830
subg. Homoeonychia Brauer & Bergenstamm, 1889
001.0 frater (Rondani, 1859) N S
002.0 lithosiophaga (Rondani, 1859) N S
217.0. Chrysosomopsis Townsend, 1916
001.0 auratus (Fallén, 1820) N S
218.0. Lydina Robineau-Desvoidy, 1830
001.0 aenea (Meigen, 1824) N
219.0. Lypha Robineau-Desvoidy, 1830
001.0 dubia (Fallén, 1810) N
002.0 ruficauda (Zetterstedt, 1838) N
220.0. Petagnia Rondani, 1856
001.0 subpetiolata Rondani, 1859 N
221.0. Ernestia Robineau-Desvoidy, 1830
001.0 argentifera (Meigen, 1824) N
002.0 puparum (Fabricius, 1794) N
003.0 rudis (Fallén, 1810) N
004.0 vagans (Meigen, 1824) N
222.0. Fausta Robineau-Desvoidy, 1830
001.0 nemorum (Meigen, 1824) N
223.0. Eurithia Robineau-Desvoidy, 1844
001.0 anthophila (Robineau-Desvoidy, 1830) N S
002.0 caesia (Fallén, 1810) N
003.0 connivens (Zetterstedt, 1844) N S
004.0 consobrina (Meigen, 1824) S
005.0 fucosa Mesnil, 1975 N
006.0 suspecta (Pandellé, 1896) N
007.0 vivida (Zetterstedt, 1838) N
224.0. Emporomyia Brauer & Bergenstamm, 1891
001.0 kaufmanni Brauer & Bergenstamm, 1891 N
225.0. Hyalurgus Brauer & Bergenstamm, 1893
001.0 crucigera (Zetterstedt, 1838) N
226.0. Gymnocheta Robineau-Desvoidy, 1830
001.0 viridis (Fallén, 1810) N
227.0. Zophomyia Macquart, 1835
001.0 temula (Scopoli, 1763) N S
228.0. Cleonice Robuneau-Desvoidy, 1863
001.0 callida (Meigen, 1824) N S
229.0. Loewia Egger, 1856
001.0 adjuncta Herting, 1971 N
002.0 alpestris (Villeneuve, 1920) N
003.0 brevifrons (Rondani, 1856) N
004.0 nudigena Mesnil, 1973 N
005.0 setibarba Egger, 1856 N S
230.0. Synactia Villeneuve, 1915
001.0 parvula (Rondani, 1861) N
231.0. Pseudopachystylum Mik, 1891
001.0 gonioides (Zetterstedt, 1838) N
232.0. Brachymera Brauer & Bergenstamm, 1889
001.0 letochai (Mik, 1874) N
002.0 rugosa (Mik, 1863) N
233.0. Pelamera Herting, 1969
001.0 atra (Rondani, 1861) N
234.0. Macquartia Robineau-Desvoidy, 1830
001.0 chalconota (Meigen, 1824) N S
002.0 dispar (Fallén, 1820) N S
003.0 grisea (Fallén, 1810) N S
004.0 praefica (Meigen, 1824) N S
005.0 pubiceps (Zetterstedt, 1845) N
006.0 tenebricosa (Meigen, 1824) N S
007.0 tessellum (Meigen, 1824) N S Si
235.0. Anthomyiopsis Townsend, 1916
001.0 plagioderae Mesnil, 1972 N
236.0. Triarthria Stephens, 1829
001.0 setipennis (Fallén, 1810) N S
237.0. Neaera Robineau-Desvoidy, 1830
001.0 laticornis (Meigen, 1824) N
238.0. Neoplectops Malloch, 1930
001.0 pomonellae (Schnabl & Mokrzecki, 1903) S
239.0. Elfia Robineau-Desvoidy, 1850
001.0 cingulata (Robineau-Desvoidy, 1830) N
240.0. Phytomyptera Rondani, 1845
001.0 nigrina (Meigen, 1824) N S Si
002.0 stackelbergi Mesnil, 1963 S
241.0. Graphogaster Rondani, 1868
001.0 buccata Herting, 1971 N
002.0 dispar (Brauer & Bergenstamm, 1889) N
003.0 vestita Rondani, 1868 N S
242.0. Ancistrophora Schiner, 1865
001.0 mikii Schiner, 1865 N
243.0. Ceromya Robineau-Desvoidy, 1830
001.0 bicolor (Meigen, 1824) N
002.0 silacea (Meigen, 1824) N
244.0. Actia Robineau-Desvoidy, 1830
001.0 crassicornis (Meigen, 1824) N S
002.0 dubitata Herting, 1971 Sa
003.0 infantula (Zetterstedt, 1844) N S
005.0 lamia (Meigen, 1838) N
006.0 maksymovi Mesnil, 1952 N
007.0 pilipennis (Fallén, 1810) N S Si
245.0. Peribaea Robineau-Desvoidy, 1863
001.0 apicalis Robineau-Desvoidy, 1863 N S
002.0 fissicornis (Strobl, 1909) N S
003.0 tibialis (Robineau-Desvoidy, 1851) N S
246.0. Ceranthia Robineau-Desvoidy, 1830
001.0 samarensis (Villeneuve, 1921) N
247.0. Siphona Meigen, 1803
001.0 collini Mesnil, 1960 N
002.0 confusa Mesnil, 1961 S Si
003.0 cristata (Fabricius, 1805) N
004.0 flavifrons Staeger, 1849 N
005.0 geniculata (DeGeer, 1776) S
006.0 paludosa Mesnil, 1960 N
007.0 pauciseta Rondani, 1865 N S
008.0 setosa Mesnil, 1960 N
248.0. Aphria Robineau-Desvoidy, 1830
001.0 latifrons Villeneuve, 1908 N
002.0 longilingua Rondani, 1861 N
003.0 longirostris (Meigen, 1824) N S
249.0. Demoticus Macquart, 1854
001.0 plebejus (Fallén, 1810) N
250.0. Bithia Robineau-Desvoidy, 1863
001.0 demotica (Egger, 1861) N
002.0 glirina (Rondani, 1861) N S
003.0 modesta (Meigen, 1824) N S
004.0 proletaria (Egger, 1860) N
005.0 spreta (Meigen, 1824) N S
251.0. Leskia Robineau-Desvoidy, 1830
001.0 aurea (Fallén, 1820) N S
252.0. Solieria Robineau-Desvoidy, 1848
001.0 fenestrata (Meigen, 1824) N
002.0 inanis (Fallén, 1810) N
003.0 pacifica (Meigen, 1824) N
004.0 vacua (Rondani, 1861) N
253.0. Fischeria Robineau-Desvoidy, 1830
001.0 bicolor Robineau-Desvoidy, 1830 N S Si
254.0. Clausicella Rondani, 1856
001.0 puella (Rondani, 1861) N
002.0 suturata Rondani, 1859 N S
255.0. Mintho Robineau-Desvoidy, 1830
001.0 compressa (Fabricius, 1787) N S
002.0 rufiventris (Fallén, 1816) N S
256.0. Hyperaea Robineau-Desvoidy, 1863
001.0 femoralis (Meigen, 1824) N
002.0 sanguinea (Meigen, 1824) N S
E 003.0 tonsa (Loew, 1847) Si
257.0. Microphthalma Macquart, 1843
001.0 europaea Egger, 1860 N S
258.0. Dexiosoma Rondani, 1856
001.0 caninum (Fabricius, 1781) N
259.0. Melisoneura Rondani, 1861
001.0 leucoptera (Meigen, 1824) S
260.0. Trixa Meigen, 1824
001.0 caerulescens Meigen, 1824 N
002.0 conspersa (Harris, 1776) N
261.0. Billaea Robineau-Desvoidy, 1830
001.0 adelpha (Loew, 1873) N S
002.0 fortis (Rondani, 1862) N
003.0 irrorata (Meigen, 1826) N
004.0 lata (Macquart, 1849) Si
005.0 maritima (Schiner, 1862) N
006.0 pectinata (Meigen, 1826) N
007.0 triangulifera (Zetterstedt, 1844) N S
262.0. Dinera Robineau-Desvoidy, 1830
001.0 carinifrons (Fallén, 1816) N
002.0 ferina (Fallén, 1816) N S
003.0 grisescens (Fallén, 1816) N
263.0. Estheria Robineau-Desvoidy, 1830
001.0 bohemani (Rondani, 1862) N
002.0 cristata (Meigen, 1826) N
003.0 littoralis (Rondani, 1862) N
004.0 microcera (Robineau-Desvoidy, 1830) N
005.0 pallicornis (Loew, 1873) N
006.0 petiolata (Bonsdorff, 1866) N
007.0 picta (Meigen, 1826) Sa
264.0. Dexia Meigen, 1826
001.0 rustica (Fabricius, 1775) N S
002.0 vacua (Fallén, 1816) N
265.0. Prosena Le Peletier & Serville, 1828
001.0 siberita (Fabricius, 1775) N S
266.0. Zeuxia Meigen, 1826
001.0 aberrans (Loew, 1847) N S Si
002.0 brevicornis (Egger, 1860) N
003.0 cinerea Meigen, 1826 N S
004.0 erythraea (Egger, 1856) N S
005.0 subapennina Rondani, 1862 N
006.0 tessellata Egger, 1860 N
007.0 zernyi Mesnil, 1963 N Si
267.0. Eriothrix Meigen, 1803
001.0 apenninus (Rondani, 1862) N
002.0 argyreatus (Meigen, 1824) N
003.0 micronyx Stein, 1924 N
004.0 monticola (Egger, 1856) N
005.0 prolixa (Meigen, 1824) N S
006.0 rufomaculatus (DeGeer, 1776) N S
268.0. Trafoia Brauer & Bergenstamm, 1893
001.0 monticola Brauer & Bergenstamm, 1893 N
269.0. Campylocheta Rondani, 1859
001.0 inepta (Meigen, 1824) S
002.0 praecox (Meigen, 1824) N
270.0. Ramonda Robineau-Desvoidy, 1863
001.0 delphinensis (Villeneuve, 1922) N
002.0 plorans (Rondani, 1861) N Si
003.0 prunaria (Rondani, 1861) S
004.0 spathulata (Fallén, 1820) N
271.0. Periscepsia Gistel, 1848
001.0 carbonaria (Panzer, 1798) N S
002.0 handlirschi (Brauer & Berenstamm, 1891) N
272.0. Wagneria Robineau-Desvoidy, 1830
001.0 alpina Villeneuve, 1910 N
002.0 costata (Fallén, 1815) N
003.0 cunctans (Meigen, 1824) N
004.0 gagatea Robineau-Desvoidy, 1830 N
005.0 lacrimans (Rondani, 1861) S
273.0. Kirbya Robineau-Desvoidy, 1830
001.0 moerens (Meigen, 1830) N S
274.0. Athrycia Robineau-Desvoidy, 1830
001.0 curvinervis (Zetterstedt, 1844) N
002.0 trepida (Meigen, 1824) N
275.0. Voria Robineau-Desvoidy, 1830
001.0 ruralis (Fallén, 1810) N S
276.0. Cyrtophleba Rondani, 1856
001.0 ruricola (Meigen, 1824) N S
277.0. Klugia Robineau-Desvoidy, 1863
001.0 marginata (Meigen, 1824) N
278.0. Chaetovoria Villeneuve, 1920
001.0 antennata (Villeneuve, 1920) N
279.0. Phyllomya Robineau-Desvoidy, 1830
001.0 procera (Meigen, 1824) N
002.0 volvulus (Fabricius, 1794) N S
280.0. Thelaira Robineau-Desvoidy, 1830
001.0 leucozona (Panzer, 1809) N S
002.0 nigripes (Fabricius, 1794) N S
003.0 solivaga (Harris, 1780) S
281.0. Stomina Robineau-Desvoidy, 1830
001.0 caliendrata (Rondani, 1862) N S
002.0 calvescens Herting, 1977 N
003.0 tachinoides (Fallén, 1816) N Si
282.0. Rhamphina Macquart, 1835
001.0 pedemontana (Meigen, 1824) N
283.0. Dufouria Robineau-Desvoidy, 1830
001.0 chalybeata (Meigen, 1824) N
002.0 nigrita (Fallén, 1810) N S
284.0. Chaetoptilia Rondani, 1862
001.0 puella (Rondani, 1862) N
285.0. Rondania Robineau-Desvoidy, 1850
001.0 cucullata Robineau-Desvoidy, 1850 N S
002.0 dimidiata (Meigen, 1824) N
286.0. Microsoma Macquart, 1855
001.0 exiguum (Meigen, 1824) N
287.0. Eliozeta Rondani, 1856
001.0 helluo (Fabricius, 1805) N S
002.0 pellucens (Fallén, 1820) N
288.0. Clytiomya Rondani, 1861
001.0 continua (Panzer, 1798) N S
002.0 mesnili Kugler, 1968 S
003.0 sola (Rondani, 1861) N S
289.0. Ectophasia Townsend, 1912
001.0 crassipennis (Fabricius, 1794) N S
002.0 leucoptera (Rondani, 1865) Si
003.0 oblonga (Robineau-Desvoidy, 1830) N Si Sa
290.0. Subclytia Pandellé, 1894
001.0 rotundiventris (Fallén, 1820) N
291.0. Gymnosoma Meigen, 1803
001.0 clavatum (Rohdendorf, 1947) N S
002.0 costatum (Panzer, 1800) N
003.0 dolycoridis Dupuis, 1961 N
004.0 nitens Meigen, 1824 N Si
005.0 nudifrons Herting, 1966 N
006.0 rotundatum (Linnaeus, 1758) N S
007.0 rungsi (Mesnil, 1952) S
008.0 siculum Dupuis & Genduso, 1981 Si
292.0. Cistogaster Latreille, 1829
001.0 globosa (Fabricius, 1775) N
002.0 mesnili (Zimin, 1966) Sa
293.0. Opesia Robineau-Desvoidy, 1863
001.0 cana (Meigen, 1824) S
002.0 grandis (Egger, 1860) S
294.0. Elomya Robineau-Desvoidy, 1830
001.0 lateralis (Meigen, 1824) N Si Sa
295.0. Phasia Latreille, 1804 subg. Phasia Latreille, 1804
001.0 aurigera (Egger, 1860) N
002.0 aurulans Meigen, 1824 N
003.0 hemiptera (Fabricius, 1794) N S
004.0 obesa (Fabricius, 1798) N S Si
005.0 subcoleoptrata (Linné, 1767) N Si
296.0. Phasia Latreille, 1804
subg. Hyalomya Robineau-Desvoidy, 1830
001.0 pandellei (Dupuis, 1957) N S
002.0 pusilla Meigen, 1824 N S
297.0. Xysta Meigen, 1824
001.0 holosericea (Fabricius, 1805) N S
298.0. Catharosia Rondani, 1868
001.0 albisquama (Villeneuve, 1932) N
002.0 pygmaea (Fallén, 1815) N
299.0. Strongygaster Macquart, 1834
001.0 globula (Meigen, 1824) N
300.0. Eulabidogaster Belanovsky, 1951
001.0 setifacies (Rondani, 1861) N S
301.0. Leucostoma Meigen, 1803
001.0 crassum Kugler, 1966 N Si
002.0 meridianum (Rondani, 1868) N Si
003.0 simplex (Fallén, 1815) N
004.0 tetraptera (Meigen, 1824) N
005.0 turonicum Dupuis, 1964 S
302.0. Clairvillia Robineau-Desvoidy, 1830
001.0 biguttata (Meigen, 1824) N S Si
002.0 pninae Kugler, 1971 Si
303.0. Brullaea Robineau-Desvoidy, 1863
001.0 ocypteroidea Robineau-Desvoidy, 1863 N
304.0. Labigastera Macquart, 1834
001.0 forcipata (Meigen, 1824) N
002.0 nitidula (Meigen, 1824) Si
002.0 pauciseta (Rondani, 1861) N
305.0. Lophosia Meigen, 1824
001.0 fasciata Meigen, 1824 S
306.0. Cylindromyia Meigen, 1803 subg. Cylindromyia Meigen, 1803
001.0 bicolor (Olivier, 1812) N S
002.0 brassicaria (Fabricius, 1775) N S Si
003.0 brevicornis (Loew, 1844) N
004.0 pilipes (Loew, 1844) N S
005.0 xylotina (Egger, 1860) N
307.0. Cylindromyia Meigen, 1803 subg. Exogaster Rondani, 1856
001.0 rufifrons (Loew, 1844) N Si
308.0. Cylindromyia Meigen, 1803 subg. Ocypterula Rondani, 1856
001.0 pusilla (Meigen, 1824) N S
309.0. Cylindromyia Meigen, 1803 subg. Conopisoma Speiser, 1910
001.0 rufipes (Meigen, 1824) N
310.0. Cylindromyia Meigen, 1803 subg. Dupuisia Lehrer, 1973
001.0 crassa (Loew, 1845) Si
311.0. Cylindromyia Meigen, 1803 subg. Calocyptera Herting, 1983
001.0 intermedia (Meigen, 1824) N
312.0. Cylindromyia Meigen, 1803
subg. Neocyptera Townsend, 1916
001.0 auriceps (Meigen, 1838) N S
002.0 interrupta (Meigen, 1824) N
003.0 scapularis (Loew, 1845) Si
313.0. Hemyda Robineau-Desvoidy, 1830
001.0 obscuripennis (Meigen, 1824) N
002.0 vittata (Meigen, 1824) S
314.0. Besseria Robineau-Desvoidy, 1830
001.0 anthophila (Loew, 1871) N
002.0 lateritia (Meigen, 1824) N
003.0 reflexa Robineau-Desvoidy, 1830 S
004.0 zonaria (Loew, 1847) Si Sa
315.0. Phania Meigen, 1824
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Miasi Foruncolosa. Un medico DAN spiega perché dovremmo tenere pulite e coperte le ferite
|
 |
by
Dottor Edgar Maeyens Jr. Tuesday, Oct. 18, 2005 at 9:46 PM |
mail:
|
Miasi Foruncolosa. Un medico DAN spiega perché dovremmo tenere pulite e coperte le ferite quando viaggiamo.
Con l’incremento dei viaggi internazionali verso mete esotiche, i subacquei hanno a disposizione un'infinità di località per immersioni da visitare, ma devono affrontare alcuni rischi legati all’ambiente.
Accanto al rischio di scottature solari, i subacquei quando viaggiano sono maggiormente esposti al rischio di venire a contatto con insetti vettori di malattie. Un esempio abbastanza comune è la mosca (botfly) Dermatobia hominis.
Questa mosca è responsabile di una malattia della pelle chiamata miasi foruncolosa (furuncolar myiasis). I subacquei che si trovano in Messico, America del Sud e Centrale e Trinidad rischiano di essere aggrediti da questi ditteri, ossia insetti con due ali. Cos’è la miasi foruncolosa? Un foruncolo è un rigonfiamento localizzato e infiammato della pelle e dei tessuti sottostanti provocato da un’infezione batterica di un follicolo pilifero o di una ghiandola cutanea; emette pus e un cuore centrale di tessuto morto. La miasi è un’infestazione ai danni di animali vertebrati ed esseri umani da parte di larve di insetti ditteri. Queste larve si nutrono dei tessuti morti o vitali del loro ospite, dei liquidi corporei o dei cibi ingeriti. Tra i vertebrati le vittime sono mammiferi, anfibi, rettili e uccelli.
Classificazione delle Miasi
Esistono tre forme di miasi la cui classificazione è basata sulla relazione parassita / ospite:
Obbligata: le larve della mosca devono svilupparsi sopra o all’interno dell’organismo dei loro ospiti viventi.
Facoltativa: le larve possono svilupparsi su materia organica sia viva che morta.
Accidentale: le larve si sviluppano nel tratto intestinale dopo essere state inavvertitamente ingerite.
Ciclo vitale di Dermatobia hominis
Dermatobia hominis è una specie di mosca (botfly) le cui larve si sviluppano sulla pelle degli esseri umani e di molti animali domestici. Comunemente conosciuti come "tafani", sono parassiti completamente obbligati che ricavano tutte le loro necessità nutrizionali per la vita adulta durante lo stadio larvale.
Gli adulti non si alimentano nel breve periodo dei loro 6 – 9 giorni di vita.
Dermatobia hominis aggredisce l’insetto vettore (ad es. una zanzara) e deposita le uova nel suo addome, dove esse si incubano. Quando la zanzara si alimenta le larve si schiudono in risposta al cambiamento di temperatura corporea della vittima; poi si trasferiscono sulla pelle dell’insetto e da qui penetrano nell’organismo dell’ospite finale sia direttamente che attraverso la puntura della zanzara. Le larve si scavano una tana nel tessuto sottocutaneo (la componente grassa della pelle) per iniziare il loro sviluppo. Qui restano una media di 35 – 45 giorni, poi escono dall’ospite, cadono sul terreno, si impupano e volano via.
La "botfly" allo stadio adulto è lunga da 1,5 a 2 centimetri, il torace blu – nero e l’addome con un riflesso metallico blu – viola. La larva si sviluppa attraverso tre stadi.
Stadio 1 ("Primo Instar") è la larva appena schiusa che invade inizialmente l’ospite.
Stadio 2 ("Secondo Instar") sono le larve che risiedono nel tessuto sottocutaneo per 5 – 10 settimane. In questo periodo la morfologia cambia da un piccolo ovale a un fiaschetto. [ La piccola larva nella foto 3]
Stadio 3 ("Terzo instar") sono le larve completamente sviluppate e fusiformi. [La grande larva nella foto 3]
Manifestazioni cliniche e infestazione
Dottor Edgar Maeyens Jr.
La penetrazione della larva attraverso la pelle non è dolorosa e di solito avviene nelle zone esposte, dove gli insetti possono facilmente pungere. Con la miasi foruncolosa la lesione iniziale è una piccola papula rosa che gradualmente si allarga fino a formare un nodulo rosso a forma di cupola con un’apertura centrale (poro), che rassomiglia ad un foruncolo. Il poro permette alla larva di respirare, ed un’ispezione ravvicinata spesso rivela i movimenti respiratori della larva.
Per capire velocemente se la larva è presente ponete una piccola quantità di saliva sul poro respiratorio; se si forma schiuma significa che c’è la larva. Il nodulo che contiene la larva è di solito non più grande di un centimetro. Una volta all’interno del nodulo la larva non migra e rimane localizzata nel tessuto grasso. Le lesioni visibili sulla superficie della pelle spesso trasudano un secreto chiaro dall’apertura del poro. E’ raro che si sviluppi un’infezione, ed in quel caso il dolore e il pus sono il risultato di un’infezione batterica secondaria, non dell’insetto stesso.
I noduli sono la conseguenza della formazione di cavità nel tessuto sottocutaneo, dell’infiammazione e della crescita della larva (vedi foto 1 e 2). Come si vede nella foto 2, un sottile strato di tessuto necrotico (cioè la zona rosso scuro) circonda immediatamente la larva, consentendole di nutrirsi di detriti cellulari ed essudati (la materia che trasuda da un’infestazione).
Diagnosi differenziale
Altre infestazioni che presentano gli stessi segni e sintomi sono: infezioni stafilococciche, granulomi da morso di zecca (tick-bite), infezioni fungine profonde, Bartonellosi (malattia da graffio del gatto), tungiasi (infestazione cutanea provocata da una mosca) ed infestazioni con vermi parassiti come Onchacerca, Loa-loa o Dirofilaria. Se la diagnosi è incerta potete osservare la lesione in cerca della protrusione o del movimento della larva, o fare il "test della saliva". L’incisione o l’escissione rivelano inevitabilmente il colpevole.
Prevenzione
Tenete pulite e coperte tutte le ferite.
Usate repellenti per respingere gli assalti degli insetti.
Cercate di soggiornare in luoghi con porte e finestre schermate. Non dormite fuori durante il giorno, quando gli insetti vettori sono più attivi.
Poiché le larve sono in grado di attraversare tessuti a trama larga, cospargete gli abiti con repellente per gli insetti per evitare gli attacchi.
Trattamento:
Il trattamento definitivo della miasi foruncolosa consiste nel rimuovere la larva e assumere antibiotici se vi è un’infezione. Esistono svariati metodi aneddotici non invasivi per convincere la larva ad abbandonare volontariamente il suo ospite. Coprire il foro respiratorio con grasso di maiale, cera d’api, paraffina, nastro adesivo, gomma da masticare, smalto per unghie o carne cruda.
Con questi metodi la larva, impossibilitata a respirare, uscirà in cerca di ossigeno. Personalmente consiglio l’estrazione chirurgica dell’intera creatura. Si riduce così il pericolo che restino in loco frammenti della larva, che possono causare infezione e reazioni avverse. Inoltre in sede di estrazione chirurgica è più facile pulire la ferita e scoprire un’infezione occulta nel suo primo stadio di sviluppo.
www.daneurope.org/ad6pag3.htm
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Miasi cutanea: un casoimportato dal Senegal
|
 |
by
zZz zzzzzzzzzzzzzzzzzZZZZZZZZZZzzzzzzzzzzzzzz Tuesday, Oct. 18, 2005 at 10:03 PM |
mail:
|
Questa è la versione .html del file contenuto in http://www.simt.it/2000-01-02/29.pdf.
G o o g l e crea automaticamente la versione .html dei documenti durante la scansione del Web.
Per inserire un segnalibro o un collegamento alla pagina, utilizzare il seguente URL:http://www.google.com/search?q=cache:7Pp0Lc5kxPsJ:www.simt.it/2000-01-02/29.pdf+Dermatobia+hominis&hl=it&lr=lang_it
Google non è collegato agli autori di questa pagina e non è responsabile del suo contenuto.
Sono state evidenziate le seguenti parole chiave: dermatobia hominis
--------------------------------------------------------------------------------
Page 1
Miasi cutanea: un casoimportato dal SenegalG. MARCHIONI1, A. DITOMMASO1, L. SILVESTRI1, P.FERRARESE1, M. VALLI1, A. BORRI2, V. MARIN31 Dipartimento di Prevenzione, ULSS 13 Dolo/Mirano(Venezia)2 U.O. Malattie Infettive - O.C. Mestre3 Istituto di Igiene - Università di PadovaDermal Myiasis: an imported case from SenegalAbstract - In recent years, international travels havehad an enormous increase. Consequently, more andmore health services have raised in Italy in order tosolve health problems especially occurring in peoplecoming back from developing countries.Some diseases are infrequent in our daily medicalpractice, so that their identification is not alwayseasy. A dermal myiasis in a woman returned from Senegalin February 2000 is reported in this article and itsrelevance in our public health system is discussed. Riassunto - Negli ultimi anni il numero dei viaggiato-ri diretti verso mete internazionali è notevolmenteaumentato. Questo fatto ha determinato lo sviluppodella cosiddetta Medicina del Turismo che trovanegli Ambulatori di Profilassi per ViaggiatoriInternazionali una risposta concreta ai molteplici pro-blemi da affrontare. Uno di essi è dato dalle possibilipatologie importate dai viaggiatori al loro rientro inpatria, non sempre frequenti da vedere e da ricono-scere.Il presente articolo riporta un caso di miasi cutaneariscontrato in una ragazza ritornata in Italia dopo unsoggiorno effettuato in Senegal nei primi mesi del2000.Key words: International Travels, Myiasis,PreventionINTRODUZIONENegli ultimi anni le persone che per motivi turi-stici, lavorativi e religiosi intraprendono viaggiinternazionali sono in continuo aumento. Ilrecarsi verso aree con differenti situazioni cli-matiche, con abitudini alimentari e comporta-mentali diverse da quelle abituali, espone ilviaggiatore a rischi di salute, specie se le con-dizioni igieniche dei Paesi visitati sono precarie. Importanti studi, basati sulla somministrazionedi un questionario nel quale i viaggiatori descri-vevano i problemi sanitari insorti durante il viag-gio, riportano una frequenza di disturbi variabiledal 15% al 43% (REID et al., 1980; STEFFENet al., 1987).La maggior parte degli autori concorda nell’i-dentificare nella diarrea il primo problema sani-tario (dal 50 al 66%), seguita dalle affezioni del-le prime vie respiratorie (14-31%), dalla febbre(12-15%) e dalla sintomatologia di tipo derma-tologico (1-2%) (REID et al., 1980; STEFFENet al., 1987; KENDRICK, 1972; PELTOLA etal., 1983).Si tratta di una classificazione che, essendobasata essenzialmente su una descrizione disintomi, comprende, all’interno di ogni gruppo,affezioni nosologiche molteplici e ben distintetra loro (basti pensare a quante patologie pos-sano provocare febbre).Per rispondere alle esigenze di chi per motividiversi si accinge ad intraprendere un viaggiointernazionale, si è venuta configurando unarete di ambulatori di prevenzione (APVI -Ambulatorio di Prevenzione per i ViaggiatoriInternazionali), gestiti per lo più da medici deiServizi di Igiene e Sanità Pubblica delleAziende ULS, che operano ormai da quasi undecennio in varie regioni italiane.Fin dal 1991 il nostro Servizio di Igiene e SanitàPubblica ha attivato questo tipo di ambulatorio,fornendo ai viaggiatori internazionali un numerodi consulenze che è andato progressivamenteaumentando nel corso degli anni, come risultadall’andamento evidenziato in tabella 1.Inoltre, come conseguenza della variabilità del-le destinazioni, aumenta la probabilità di rileva-GIORNALEITALIANO DIMEDICINATROPICALEVOL. 5, N. 1-2, 200029La corrispondenza deve essere indirizzata a:Dott. Giovanni MarchioniVia XXIX Aprile n. 2, 30031 Dolo (Venezia)Tel . 041 5139246 – Fax 041 410143E-mail: ulss13dolo.sispmar@tin.itNOTA BREVETabella 1 - Andamento delle consulenze e deifollow up eseguiti nell’Ambulatorio diPrevenzione per Viaggiatori Internazionali delServizio di Igiene e Sanità Pubblica delDipartimento di Prevenzione dell’ASL 13(Regione Veneto) sede di Dolo dal 1991 al 1999.
--------------------------------------------------------------------------------
Page 2
G. MARCHIONI ET AL.30re nei viaggiatori di ritorno da soggiorni esoticicasi di patologie fino ad oggi di rara osservazio-ne.Tra queste si possono senz’altro comprenderele parassitosi trasmesse per via transcutaneaquali ad esempio la schistosomiasi, le infesta-zioni da nematodi intestinali, la sindrome da lar-va migrans e le ectoparassitosi come la tungia-si (pulce penetrante) e la miasi (CAUMES,1996).E proprio a quest’ultima patologia si riferisce ilcaso, giunto alla nostra osservazione, di cuidaremo descrizione in seguito.Miasi Le miasi sono condizioni morbose dovute adinfestazioni di larve di mosche che si sviluppa-no negli organi o nei tessuti di vertebrati. Sitratta di parassitosi diffuse soprattutto nei Paesitropicali ma presenti anche nelle zone a climatemperato (ADAM et al., 1994).Possiamo distinguere, a seconda della localiz-zazione, quadri clinici diversi.Le miasi epicutanee (mosca responsabile:Auchmeromya luteola) sono diffuse in paesitropicali africani e in genere non determinanodanni significativi.Nelle miasi delle ferite e delle ulcere, cosiddettemiasi traumatiche, (mosche responsabili appar-tenenti ai generi Chrysomia, Wohlfahrtia,Lucili a e Callitroga , nonché la temibileCochliomyia hominivorax), l’infestazione èdeterminata dalle mosche che vengono attiratedall’odore delle ferite secernenti e dai tessuti innecrosi. Ne possono derivare processi distrutti-vi anche molto estesi con gravi pericoli disovrainfezione (ESPOSITO, 1994). Si tratta diforme diffuse soprattutto negli animali di alleva-mento ma che possono diffondersi all’uomo(AMIN 1997).Nell’area mediterranea l’infestazione è presen-te, come testimoniato ad esempio da oltre 200casi verificatisi in Libia tra il 1988 al 1989,dovuti a Cochliomyia hominivorax, un genere dimosca diffuso in precedenza nel ContinenteAmericano, Messico e Sudamerica in particola-re (EL AZAZI, 1992; BEESLEY, 1991).Le miasi sottocutanee sono senza dubbio le piùdiffuse. Sono provocate da ditteri a parassiti-smo obbligato, le cui larve si sviluppano nellacute o nel connettivo sottocutaneo.In Africa centrale di solito queste lesioni sonoprodotte dalla mosca tumbu (Cordylobia anth-ropophaga). Questi ditteri depositano le lorouova sul terreno sabbioso o sul bucato stesoad asciugare. Le larve si schiudono e invadonola cute intatta dell’uomo, dove maturano in 8 o9 giorni determinando lesioni di tipo foruncoloi-de da cui emergono spontaneamente per com-pletare lo sviluppo all’esterno qualora non ven-gano estratte prima chirurgicamente o non sia-no fuoriuscite in seguito alla applicazione sull’o-rifizio al centro della lesione di una goccia diolio minerale. Spesso però, in questo tipo diinfestazione, può essere opportuno lasciareche le larve maturino e fuoriescano spontanea-mente. Le infestazioni dovute invece aDermatobia hominis provocano sulla cute, dopouna maturazione di circa sei settimane, tumefa-zioni rossastre secernenti un essudato similpurulento. Curiosa la modalità di trasmissioneche prevede l’intervento di un altro dittero(mosche, zanzare, zecche) su cui laDermatobia hominis depone primariamente leuova, inoculate successivamente con la puntu-ra dell’altro vettore.Miasi oftalmiche, delle cavità naturali, auricolarie viscerali (quest’ultime molto rare) possonoaltresì conseguire ad infestazioni da Oestrusovis, agente noto da molti anni e responsabiledi infestazioni degli allevamenti di pecore ecapre nell’area mediterranea, propagantisiall’uomo in molti casi.Un medico siciliano dello scorso secolo, G.A.Galvagni, descrisse un’elevata incidenza dimiasi in soggetti dediti alla pastorizia nell’areaetnea. Al giorno d’oggi, uno studio condottonella stessa zona della Sicilia, intervistando112 pecorai, ha rivelato che circa l’80% deglistessi aveva contratto una o più volte la miasida Oestrus ovis, agente abituale dell’estriasinegli ovini. Le localizzazioni erano state, inordine decrescente di frequenza la faringea, lacongiuntivale, la nasale e l’auricolare. Gli autorigiustificano la persistenza dell’infestazione inquell’area con le scadenti condizioni igieniche econ le abitudini e gli stili di vita dei pastori, dipoco variate rispetto ad un passato non propriorecente (PAMPIGLIONE et al., 1997)).Anche in Corsica l’interessamento oculare dalarve di Oestrus ovis non è infrequente, essen-do causa di una forma di congiuntivite acutamonolaterale di tipo petecchiale (MARIOTTI eVACHERET, 1992).Uno studio francese condotto su viaggiatori diritorno da viaggi internazionali svoltisi fuoridall’Europa ha rivelato, tra le altre patologie,l’ectoparassitosi causata da mosche in unadiscreta percentuale (circa il 10%) (CAUMESet al., 1991), così come altri casi si sono riscon-trati in viaggiatori di ogni parte del mondo alloro rientro in patria (RUBEL et al., 1993; TANI-GUCHI et al., 1996).Dati di revisione della letteratura internazionalerivelano pure 23 casi di miasi nosocomiale,verificatisi laddove le condizioni ambientali e lelocalizzazioni degli ospedali ne favorivano l’in-sorgenza (MIELKE, 1997).Descrizione del casoIl 4 marzo 2000 una paziente, C.G. italiana di24 anni, è giunta alla nostra osservazione pres-
--------------------------------------------------------------------------------
Page 3
so l’Ambulatorio di Prevenzione per ViaggiatoriInternazionali, di ritorno da un viaggio turisticoeffettuato in Senegal dal 17 gennaio al 28 feb-braio 2000. La paziente riferiva di essere stata ospitata daamici ivi residenti. L’abitazione in cui avevasoggiornato era situata in zona rurale e concaratteristiche dal punto di vista igienico quan-tomeno precarie. Infatti, aveva dormito in unsacco a pelo steso su di un pavimento incemento. Inoltre, nelle vicinanze dell’abitazionevenivano portate al pascolo delle capre.Dopo circa quattro settimane di permanenza,durante le quali la paziente aveva condiviso leabitudini locali, aveva notato la comparsa dialcuni foruncoli consistenti e dolenti, del diame-tro di mezzo centimetro, con un punto nerocentrale.Tali lesioni provocavano un dolore urentesoprattutto di notte.Dopo quattro, cinque giorni dalla comparsa, lelesioni erano notevolmente aumentate di dia-metro e avevano cominciato a secernere delmateriale bianco-giallastro simil purulento.C.G. si rivolgeva allora ad un farmacista dellacittà più vicina che le consigliava un antibioticoa largo spettro e un digestivo, in quanto talereazione veniva dallo stesso attribuita ad uncattivo funzionamento del fegato dovuto adun’alimentazione inadeguata.Rientrata in Italia, la paziente aveva smesso diassumere l’antibiotico in seguito alla comparsadi una reazione allergica diffusa di tipo ortica-rioide.All’esame obiettivo si notavano delle lesioni cir-colari, rilevate, del diametro di 2 cm, di consi-stenza duro-elastica, di colorito rosso violaceo,ombelicate al centro e localizzate una al polso,tre al gluteo, quattro al tronco.Gli organi ipocondriaci erano nei limiti e le sta-zioni linfonodali risultavano indenni. Non pre-sentava febbre. La cute evidenziava un eritema diffuso verosi-milmente di origine iatrogena.In base all’anamnesi e alle caratteristiche dellelesioni cutanee veniva formulato il sospetto dia-gnostico di miasi.La paziente era invitata a recarsi pressol’Ambulatorio dell’Unità Operativa di MalattieInfettive dell’Ospedale Civile di Mestre per unaconsulenza specialistica, dove trovava confer-ma la diagnosi di miasi (vedi fig. 1 – Miasi cuta-nea: lesioni in fase di risoluzione, parzialmentemascherate da applicazione locale di mercuro-cromo ed eritema da farmaci).Le larve non sono giunte alla nostra osserva-zione, per cui non è stato possibile effettuarne ilriconoscimento (ci veniva peraltro riferito dalCentro di Mestre di una recente analoga osser-vazione, più fortunata, da cui era stato possibileestrarre oltre cento larve di mosca).CONCLUSIONIAbbiamo ritenuto opportuno portare all’attenzio-ne questa osservazione non tanto per la rile-vanza epidemiologica e clinica che riveste,quanto per sottolineare essenzialmente alcuniaspetti.Ci pare necessario lavorare per fornire ai viag-giatori in partenza per mete esotiche un’educa-zione sanitaria tale che possano mettere in attocomportamenti e stili di vita idonei al tipo edalla meta del viaggio che stanno per intrapren-dere. Spesso infatti, potrebbero realizzarsi con-dizioni favorenti per l’insorgere di una patologiadi tipo infettivo e/o parassitario. Dati preliminaridi una nostra ricerca effettuata su un campionedi viaggiatori rivelerebbero una preparazioneinsufficiente anche in coloro i quali abbiano giàalle spalle reiterati viaggi esotici o siano dotatidi cultura medio-superiore. E’ da ribadire poi l’importanza di una formazio-ne adeguata da fornire al personale impegnatoin questi Ambulatori anche a fronte di patologierare o di non facile diagnosi.La creazione di idonei strumenti sia per la rile-vazione dei dati epidemiologici che di Verificadi Qualità degli stessi, si pone come ultimo mafondamentale step nell’organizzazione di que-sto settore sanitario ormai definito Medicina delTurismo. Per la raccolta, l’archiviazione e lasistematizzazione dei dati relativi alle consulen-ze fornite ai viaggiatori è opportuno dotarsi distrumenti informatici agili, flessibili nell’adattarsia nuove esigenze che di giorno in giorno ven-gano a proporsi. Accanto a ciò è auspicabileche vengano condotti adeguati programmi difollow up sui viaggiatori al ritorno dalle metevisitate (MARIN et al. 1998). Una scheda di fol-low up comune, di cui possano dotarsi i variMIASI CUTANEA: UN CASO IMPORTATO DALSENEGAL31Figura 1 – Miasi cutanea: papula al polso destroed eritema da farmaci.
--------------------------------------------------------------------------------
Page 4
centri che forniscono consulenze ai viaggiatoriinternazionali, sembra essere un’utile propostaper migliorare la qualità del sevizio, soprattuttoin rapporto alla soddisfazione degli operatori edalla qualità percepita dagli utenti. L’organizzazione in rete degli Ambulatori per laProfilassi dei Viaggiatori Internazionali, volutadalla Regione Veneto sembra muoversi proprioin questa direzione. BIBLIOGRAFIAADAM K.M.G., WILSON P.A.G., CAMPBELL J.A(1994). Argomenti di Parassitologia Medica.Piccin Editore, Padova.AMIN A.R., MORSY T.A., SHOUKRY A., MAZYADS.A. (1997). Studies of wound myiasis amongsheep and goats in North Sinai GovernorateEgypt. Journal of the Egyptian Society ofParasitology, 27(3): 719-737.BEESLEY W.N. (1991). The new world screw-wormfly in North Africa. Annals of Tropical Medicineand Parasitology, 85(1): 173-179. CAUMES E., BELANGER F., BRUCKER G., DANISM., GENTILINI M. (1991). Diseases observedafter return from travels outside Europe. 109cases. Presse Medicale, 20(31): 1483-1486.CAUMES E. (1996). Health and Travel. PasteurMerieux MSD. Zurich. 42 pp.EL AZAZI O.M. (1992). Observations on the NewWorld screwworm fly in Lybia and the risk of itsentrance into Egypt. Veterinary Parasitology,42(3-4): 303-310.ESPOSITO R. (1994). Manuale di ParassitologiaClinica e Tropicale. 2a Edizione, Masson,Milano, pp. 446-447.KENDRICK M.A. (1972). From the CDC: study ofilness among Americans returning frominternational travel, July 11-August 24, 1971(preliminary data). Journal of InfectiousDiseases, 126: 684-685.MARIN V., VALLI M., FRANCHIN D., MARCHIONIG., MORETTI G. (1998). Valutazione del rischioinfettivo nel viaggiatore internazionale: Propostadi scheda per follow up. Annali di Igiene, 10(4):217.MARIOTTI J.M., VACHERET G. (1992). Conjunctivalmyiasis, a frequent pathology in Corsica.Journal Francais d’Ophtalmologie, 15(12): 679-682.MIELKE U. (1997). Nosocomial myiasis. Journal ofHospital Infection, 37(1): 1-5. PAMPIGLIONE S., GIANNETTO S., VIRGA A.(1997). Persistence of human myiasis byG. MARCHIONI ET AL.32</html
www.simt.it/2000-01-02/29.pdf
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
In Europa si manifesta soprattutto come malattia di importazione dovuto all’aumentata ....
|
 |
by
di qualcosa si deve morire Thursday, Oct. 20, 2005 at 12:20 AM |
mail:
|
Febre Dengue
Di origine virale, la dengue è causata da quattro virus molto simili (Den-1, Den-2, Den-3 e Den-4) ed è trasmessa agli esseri umani dalle punture di zanzare che hanno, a loro volta, punto una persona infetta. Non si ha quindi contagio diretto tra esseri umani, anche se l’uomo è il principale ospite del virus. Il virus circola nel sangue della persona infetta per 2-7 giorni, e in questo periodo la zanzara può prelevarlo e trasmetterlo ad altri.
Nell’emisfero occidentale il vettore principale è la zanzara Aedes aegypti, anche se si sono registrati casi trasmessi da Aedes albopictus. La dengue è conosciuta da oltre due secoli, ed è particolarmente presente durante e dopo la stagione delle piogge nelle zone tropicali e subtropicali di Africa, Sudest asiatico e Cina, India, Medioriente, America latina e centrale, Australia e diverse zone del Pacifico. Negli ultimi decenni, la diffusione della dengue è aumentata in molte regioni tropicali. Nei paesi dell’emisfero nord, in particolare in Europa, costituisce un pericolo in un’ottica di salute globale, dato che si manifesta soprattutto come malattia di importazione, il cui incremento è dovuto all’aumentata frequenza di spostamenti di merci e di persone.
Sintomi e diagnosi
Normalmente la malattia dà luogo a febbre nell’arco di 5-6 giorni dalla puntura di zanzara, con temperature anche molto elevate. La febbre è accompagnata da mal di testa acuti, dolori attorno e dietro agli occhi, forti dolori muscolari e alle articolazioni, nausea e vomito, irritazioni della pelle che possono apparire sulla maggior parte del corpo dopo 3-4 giorni dall’insorgenza della febbre. I sintomi tipici sono spesso assenti nei bambini.
La diagnosi è normalmente effettuata in base ai sintomi, ma può essere più accurata con la ricerca del virus o di anticorpi specifici in campioni di sangue.
Prevenzione e trattamento
La misura preventiva più efficace contro la dengue consiste nell’evitare di entrare in contatto con le zanzare vettore del virus. Diventano quindi prioritarie pratiche come l’uso di repellenti, vestiti adeguati e protettivi, zanzariere e tende. Dato che le zanzare sono più attive nelle prime ore del mattino, è particolarmente importante utilizzare le protezioni in questa parte della giornata.
Per ridurre il rischio di epidemie di dengue, il mezzo più efficace è la lotta sistematica e continuativa alla zanzara che funge da vettore della malattia. Ciò significa eliminare tutti i ristagni d’acqua in prossimità delle zone abitate, ed effettuare vere e proprie campagne di disinfestazione che riducano la popolazione di Aedes.
Non esiste un trattamento specifico per la dengue, e nella maggior parte dei casi le persone guariscono completamente in due settimane. Le cure di supporto alla guarigione consistono in riposo assoluto, uso di farmaci per abbassare la febbre e somministrazione di liquidi al malato per combattere la disidratazione. In qualche caso, stanchezza e depressione possono permanere anche per alcune settimane.
La malattia può svilupparsi sotto forma di febbre emorragica con emorragie gravi da diverse parti del corpo che possono causare veri e propri collassi e, in casi rari, risultare fatali.
Attualmente sono allo studio una serie di vaccini, anche se la conoscenza del virus e del suo meccanismo di azione sono aumentate solo in anni recenti, dopo che si è registrato un incremento della diffusione della malattia. Purtroppo, l’aver contratto la dengue protegge la persona solo contro il virus che l’ha causata ma non contro gli altri tre tipi virali.
www.epicentro.iss.it/problemi/Febbre%2
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Influenza aviaria
|
 |
by
di qualcosa prima o poi se crepa no? Thursday, Oct. 20, 2005 at 12:25 AM |
mail:
|
tag<p>
|
(14 ottobre 2005) H5N1 in Turchia, nuove raccomandazioni
dell'Oms
Dopo l’identificazione
dei virus aviari in Turchia e Romania, l’Oms ricorda
che il livello di allerta pandemica rimane alla fase 3 e raccomanda tutti coloro che si mettono in
viaggio per i Paesi colpiti da influenza aviaria (Vietnam, Tailandia,
Cambogia, Indonesia, Laos, Cina, Kazakhstan, Mongolia, Russia e Turchia) di
evitare qualsiasi contatto con uccelli migratori ritrovati morti, uccelli
selvatici e con tutto il pollame presente nei mercati e negli allevamenti. Il
contatto diretto con questi animali o con oggetti e superfici contaminate dai
loro escrementi rappresenta infatti la principale via di infezione. Ad alto
rischio di esposizione al virus anche chi macella o prepara prodotti derivati
da pollame per cucinare. Non c’è alcuna prova, invece, che il pollame già
cotto sia fonte di infezione: l’Organizzazione
mondiale della sanità animale (Oie) ricorda infatti che il virus viene
ucciso se esposto per alcuni secondi alla temperatura di 70°C.
L'Oms consiglia a tutti i Paesi che hanno avuto focolai di influenza aviaria
di seguire particolari precauzioni durante le procedure di abbattimento degli
animali infetti, e di continuare a controllare le persone che possono essere
state esposte e che presentano febbre e sintomi respiratori.
Leggi l’ultimo numero di Eurosurveillance, con un articolo che fa
il punto della situazione dopo la scoperta di virus aviari in Turchia e
Romania.
(13 ottobre 2005) L’influenza aviaria alle porte dell’Europa
Identificato in un allevamento di tacchini in Turchia il virus
dell’influenza aviaria ad alta patogenicità H5N1. Migliaia i capi infetti abbattuti, introdotte
immediatamente misure preventive di quarantena. L’Unione europea ha
subito imposto il blocco delle importazioni di pollame proveniente dalla
Turchia. Lo stesso provvedimento è stato adottato anche per la Romania, dopo
che test di laboratorio hanno confermato la presenza del virus H5 in alcune anatre
morte nell’area del delta del Danubio (una delle zone più a rischio, a causa
della presenza di uccelli migratori provenienti dall’Asia e dalla Siberia,
Paesi in cui il virus ha già colpito). Ulteriori analisi serviranno ad
accertare se il virus in questione sia proprio H5N1, lo stesso che sta
circolando nel Sud-est asiatico e che è stato identificato anche in Turchia.
L’Ecdc di Stoccolma,
che ha offerto assistenza tecnica alle autorità sanitarie rumene, sottolinea
comunque che il rischio di trasmissione del virus agli uomini è basso ed è
comunque limitato solo a coloro che vengono a stretto contatto con gli
uccelli.
Intanto, in Indonesia l’Oms registra ufficialmente un nuovo
caso di influenza aviaria in un ragazzo di 21 anni, ricoverato in
ospedale in condizioni stabili, che nelle settimane scorse era venuto
direttamente a contatto con polli malati.
Su EpiCentro, consulta l’argomento di salute dedicato all’influenza
aviaria.
Nel Sud-est asiatico, dal 28 gennaio 2004 a oggi, il numero di casi umani
confermati e di decessi per influenza aviaria è:
|
Paese
|
Casi totali
|
Morti
|
|
Cambogia
|
4
|
4
|
|
Indonesia
|
5
|
3
|
|
Thailandia
|
17
|
12
|
|
Vietnam
|
91
|
41
|
|
Totale
|
117
|
60
|
(Fonte: Organizzazione
mondiale della sanità, dati aggiornati al 10 ottobre 2005)
(6 ottobre 2005) Pandemie: ricostruito il codice genetico della
spagnola, istituita un’alleanza asiatica contro il virus dei polli
Sul numero 437 della rivista britannica Nature del 6
ottobre 2005 è stato pubblicato un articolo dal titolo “Characterization
of the 1918 influenza virus polymerase genes”, a firma di Jeffery K.
Taubenberger e colleghi, dell’Istituto militare di patologia di Rockville,
Maryland, negli Stati Uniti. I ricercatori hanno analizzato il virus della
“spagnola”, l’influenza pandemica che tra il 1918 e il 1919 colpì centinaia
di milioni di persone e ne uccise quasi 50 milioni. Scopo della ricerca è la
comprensione dell’origine e dell’insolita virulenza del virus del 1918.
Secondo i ricercatori, il virus del 1918 non è il risultato di una
ricombinazione tra virus di origine aviaria e virus di origine umana (come
invece è successo nelle successive pandemie del 1957-1958 e del 1968), ma
piuttosto un virus aviario che si è adattato direttamente all’uomo.
Gli scienziati hanno scoperto che alcune mutazioni del virus H5N1
attualmente in circolazione nel Sudest asiatico sono le stesse di quelle che
hanno reso così aggressivo il virus del 1918. La composizione di alcune
proteine virali della “spagnola” risulta poi conservata anche nei virus
aviari delle pandemie di fine anni ’50 e ’60. C’è quindi la possibilità che
queste proteine siano coinvolte nel processo di adattamento del virus aviario
agli esseri umani.
L’editoriale pubblicato il 7 ottobre 2005 sul numero 5745 della rivista Science
propone una riflessione sul significato di questo studio, sulle sue
implicazioni e sulle responsabilità della ricerca scientifica. EpiCentro ne
propone una sintesi
in italiano.
Sul sito web di Nature, consulta il focus
dedicato alla pandemia del 1918. Leggi anche il comunicato
stampa dei Cdc, che sottolinea l’importanza di questi studi per aumentare
le capacità di preparazione e risposta a un’eventuale pandemia.
Nel corso di una riunione dei ministri dell’agricoltura e delle risorse
forestali, i dieci Paesi membri dell’Associazione delle nazioni del Sudest
asiatico (Asean) hanno
firmato un accordo
regionale per un piano di tre anni per controllare e sconfiggere il virus
dell’influenza aviaria. Il piano prevede otto azioni strategiche assegnate ai
diversi Paesi membri: la Tailandia dovrà gestire la sorveglianza e la
diagnosi, la Malesia si prenderà cura delle misure di contenimento e di
emergenza, l’Indonesia delle iniziative di vaccinazione, le Filippine
promuoveranno l’informazione e la conoscenza verso il pubblico mentre
Singapore garantirà il flusso e la condivisione delle informazioni. La task
force dell’Asean lavorerà congiuntamente con le organizzazioni
internazionali: Fao, Oms e Organizzazione
della sanità animale. I ministri hanno anche deciso la creazione di zone
“libere dal virus” nelle aree colpite dall’epidemia di aviaria, per
facilitare la ripresa delle esportazioni di polli dalla verso il Giappone e
altri paesi. Per la realizzazione di questo programma regionale, l’Asean ha
stabilito lo stanziamento di 2 milioni di dollari.
(29 settembre 2005) Cent’anni di influenza aviaria
Mentre in Russia diminuisce il numero degli uccelli morti a causa del virus
H5N1, la sorveglianza resta comunque alta: anche se la situazione in Asia
centrale al momento non rappresenta un pericolo immediato per l’Europa, l’Ecdc di Stoccolma
raccomanda infatti di preparare uno specifico piano pandemico per far fronte
a un’eventuale emergenza.
Il 29 settembre l'Oms ha registrato un nuovo caso
mortale in Indonesia.
Il livello di allerta, secondo il modello proposto dall’Oms,
è ora al livello 3 (casi di infezione nell’uomo, con trasmissione
estremamente rara da persona a persona), su una scala che va da 1 a 6.
Il focus messo a punto sul sito
web di Nature propone, tra l’altro, una storia delle epidemie e pandemie provocate da influenza
aviaria, dal 1890 a oggi: EpiCentro l’ha tradotta, integrandola con una mappa
interattiva.
Nel Sud-est asiatico, dal 28 gennaio 2004 a oggi, il numero di
casi umani confermati e di decessi per influenza aviaria è:
|
Paese
|
Casi totali
|
Morti
|
|
Cambogia
|
4
|
4
|
|
Indonesia
|
4
|
3
|
|
Thailandia
|
17
|
12
|
|
Vietnam
|
91
|
41
|
|
Totale
|
116
|
60
|
(Fonte:
Organizzazione mondiale della sanità, dati aggiornati al 29 settembre 2005)
(22 settembre 2005) Politica sanitaria, ricerca e
comunicazione: tre fronti di intervento
Per la sanità pubblica: il governo italiano ha approvato un decreto legge sull’influenza aviaria, con un pacchetto di
misure che prevede in particolare un approvvigionamento di scorte di farmaci
antivirali e il potenziamento delle strutture sanitarie, attraverso
l'istituzione di un Centro nazionale di lotta ed emergenza contro le malattie
degli animali e di un Dipartimento per la sanità veterinaria, la nutrizione e
la sicurezza degli alimenti. Dal 13 settembre, inoltre, il ministero della
Salute ha istituito il numero telefonico di pubblica utilità 1500 per
fornire tutte le informazioni sull’influenza aviaria. Il servizio è attivo
dal lunedì al venerdì, dalle 9.00 alle 17.00.
Sul fronte dell’epidemia in corso in estremo oriente, l’Oms
ha registrato ufficialmente altri due casi, uno in Vietnam e l’altro in
Indonesia, dove peraltro è stato deciso l’abbattimento di milioni di volatili
nelle zone in cui si è diffusa la malattia e l’introduzione della quarantena
per i casi sospetti.
In Europa, l’Agenzia per la sicurezza alimentare (Efsa) raccomanda di
tenere sotto controllo anche i virus aviari a bassa patogenicità,
individuando gli allevamenti più esposti lungo le rotte migratorie degli
uccelli selvatici e adottando misure per contenere l'insorgenza di eventuali
focolai epidemici. Nel rapporto sono indicate alcune azioni concrete che
dovrebbero essere messe in atto in ogni Paese per ridurre i rischi di un
possibile contagio tra gli animali allevati e i selvatici migratori.
Sul fronte della ricerca, uno studio
realizzato in Italia dall’Istituto superiore di sanità indica come proprio
alcuni sottotipi del virus dell'influenza aviaria a bassa patogenicità (H7N3)
siano in grado di infettare l'uomo.
Sul fronte della comunicazione, il sito
web della rivista Nature propone un focus sull’influenza aviaria,
accessibile in gran parte gratuitamente a tutti, che raccoglie le ultime
notizie, gli aggiornamenti, i commenti e gli studi sui rischi di una
possibile pandemia.
Su EpiCentro, consulta l’argomento di
salute dedicato all’influenza aviaria.
(14 settembre 2005) Domande & risposte sull’influenza
aviaria
È sempre alta l’attenzione sull’influenza aviaria: il Centro per la
prevenzione e il controllo delle malattie e la Commissione europea propongono
una serie di domande e risposte sulle caratteristiche della malattia, i
rischi per l’uomo e sulle misure di preparazione a un’eventuale pandemia:
leggi le faq del Ccm e quelle della Commissione europea, disponibili anche nella sintesi e
traduzione a cura della redazione di EpiCentro.
L’Oms pubblica un nuovo documento rivolto ai policy maker, con
l’indicazione di una serie di azioni strategiche da intraprendere in caso di emergenza.
Sul sito della Fao, una scheda sull’influenza aviaria con la descrizione dei
segni e dei sintomi degli animali colpiti dalla malattia e le vaccinazioni
consigliate in ambito veterinario. Leggi la sintesi e
traduzione, a cura della redazione di EpiCentro.
(8 settembre 2005) Il virus dei polli è alle porte dell’Europa
Il virus dei polli è arrivato in Siberia. L'Oms e la Fao temono una
diffusione in Europa nei prossimi mesi. E reagiscono con piani preventivi per
una possibile pandemia. EpiCentro aggiorna l'argomento di
salute sull'influenza aviaria con dati recenti, nuovi studi
e link, e
segnala le ultime misure predisposte dal ministero della Salute, con una nota
del ministero della Salute sull’ordinanza per le malattie dei volatili da
cortile.
Nel Sud-est asiatico, dal 28 gennaio 2004 a oggi, il numero di casi umani
confermati e di decessi per influenza aviaria è:
|
Paese
|
Casi totali
|
Morti
|
|
Cambogia
|
4
|
4
|
|
Indonesia
|
1
|
1
|
|
Thailandia
|
17
|
12
|
|
Vietnam
|
90
|
40
|
|
Totale
|
112
|
57
|
(Fonte:
Organizzazione mondiale della sanità, dati aggiornati al 15 agosto 2005)
(14 luglio 2005) Una strategia comune contro l’influenza
aviaria
Oms, Fao e Oie uniti per contrastare la diffusione dell’influenza aviaria
e scongiurare il rischio di una pandemia: vaccinazioni a tappeto dei polli e
più risorse agli Stati asiatici le misure da attuare subito per evitare
un’epidemia globale di influenza. Leggi il comunicato dell’Oms e la traduzione,
a cura della redazione di EpiCentro.
Uno studio, pubblicato on line il 6 luglio 2005 dalla rivista
scientifica Nature, descrive casi di malattia provocata da H5N1 e la
trasmissione del virus a una popolazione di oche selvatiche nella Cina
occidentale. Si tratta di una epidemia che potrebbe favorire la diffusione
della malattia attraverso la catena dell'Himalaya, con implicazioni
importanti nello sviluppo di un strategia di controllo.
Un articolo, apparso sul numero di luglio/agosto di Foreign
Affairs (il periodico dell’Ufficio affari esteri americano) sui rischi
legati alla pandemia di influenza, invita ad approntare al più presto misure
di contrasto efficaci e piani adeguati per limitare i danni di una possibile
emergenza. Leggi la traduzione, a cura della redazione di EpiCentro.
L'Oms ha predisposto un piano di preparazione all'influenza globale: guarda le presentazioni relative all'incontro tecnico
sull'influenza aviaria che si è tenuto a Ginevra il 18 maggio 2005.
Nel Sud-est asiatico, dal 28 gennaio 2004 a oggi, il numero di casi umani
confermati e di decessi per influenza aviaria è:
|
Paese
|
Casi totali
|
Morti
|
|
Cambogia
|
4
|
4
|
|
Thailandia
|
17
|
12
|
|
Vietnam
|
87
|
38
|
|
Totale
|
108
|
54
|
(Fonte:
Organizzazione mondiale della sanità, dati aggiornati al 28 giugno 2005)
(31 marzo 2005) Influenza aviaria: epidemia tra i polli in Nord
Corea
Primi casi confermati di influenza aviaria anche in Corea del Nord.
L’epidemia si è diffusa in alcuni allevamenti di polli, uno dei quali nella
provincia della capitale Pyongyang. Anche se al momento non sono stati
registrati casi umani, le autorità nordcoreane hanno deciso in via preventiva
di abbattere centinaia di migliaia di polli. L’Organizzazione mondiale della
sanità ha offerto appoggio logistico e scorte di oseltamivir, un farmaco
antivirale utilizzabile sia per la profilassi che per l’eventuale terapia.
Consulta su EpiCentro l’argomento di salute sull’influenza aviaria e sul sito
dell’Oms la sezione con tutti gli aggiornamenti sull’influenza dei
polli.
Nel Sud-est asiatico dal 28 gennaio 2004 a oggi il numero di casi umani
confermati e di decessi per influenza aviaria è:
|
Paese
|
Casi totali
|
Morti
|
|
Cambogia
|
1
|
1
|
|
Thailandia
|
17
|
12
|
|
Vietnam
|
51
|
33
|
|
Totale
|
69
|
46
|
(Fonte:
Organizzazione mondiale della sanità, dati aggiornati a 11 marzo 2005)
(9 settembre 2004) Influenza aviaria: nuovi casi
Torna l’attenzione sull’influenza aviaria. L’Organizzazione
mondiale della sanità il 9 settembre riferisce che in Tailandia dal Ministro
della salute è arrivata la notizia di un decesso da influenza aviaria A
(H5N1). Il caso riguarda un uomo di 18 anni che è stato esposto a polli
malati. L’uomo proveniva dalla provincia Prachinburi nella zona orientale
della Tailandia, una regione in cui all’inizio di quest’anno si è verificata
una epidemia da H5N1 nel pollame. L’uomo, ricoverato in ospedale il 5 settembre, è morto l’8 settembre.
Questo è solo l’ultimo caso dopo che il 7 settembre era arrivata la
notizia di un caso fatale di influenza A H5 ad Hanoi, in Vietnam. Si è in
attesa di ulteriori dettagli dall’autorità sanitaria, dal momento che la
scoperta di un sottotipo H5 di influenza A in un uomo porta con se’ la
preoccupazione che il caso possa essere stato causato dal ceppo H5N1 di
influenza aviaria, specialmente in un paese in cui è in corso un focolaio
epidemico di H5N1 nel pollame.
H5N1 è infatti il solo ceppo all’interno del sottotipo H5 che è sempre stato
associato alla malattia negli uomini.
Nei giorni scorsi, inoltre, sono arrivate notizie su possibili casi di
influenza da H5N1 nei maiali: leggi la traduzione
del comunicato dell’Oms.
Per quanto riguarda la situazione epidemiologica, da agosto, in Vietnam sono
stati rilevati 4 casi umani di infezione da H5. Questi casi si sono
verificati nel mezzo dell’epidemia da H5N1 nei polli in diverse nazioni
asiatiche.
Da gennaio di quest’anno, sono stati segnalati 39 casi umani in due paesi,
Vietnam e Tailandia. Di questi 28 hanno avuto esito fatale.
|
Paese
|
casi totali
|
decessi
|
|
Tailandia
|
12
|
8
|
|
Vietnam
|
27
|
20
|
|
Total
|
39
|
28
|
(Fonte: Organizzazione
Mondiale della Sanità, 7 settembre 2004).

|
|
www.epicentro.iss.it/focus/flu_aviaria/avian7set.asp
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Ebola torna a colpire
|
 |
by
memento moria Thursday, Oct. 20, 2005 at 12:29 AM |
mail:
|
EPIDEMIE
Ebola torna a colpire
di Licia Adami
IN UGANDA, nel cuore dell’Africa, 39 persone sarebbero morte e un’altra sessantina sarebbe stata contagiata dal terribile virus Ebola. «Aggiungiamo circa dieci casi al giorno», dice Nestor Ndayimirije, un epidemiologo dell’Organizzazione mondiale di sanità, che aiuta le autorità ugandesi a individuare la fonte dell'epidemia: «Continuerà a espandersi, finché non riusciremo a identificare e isolare tutte le persone infette». Le vittime sembrano per ora concentrate a Gulu, a nord dalla capitale Kampala, dove vengono ricoverate nell’ospedale di Lachor, costruito da missionari italiani circa sessant'anni fa. La notizia, comunicata direttamente dal ministro della sanità ugandese Crispus Kiyonga, in un drammatico messaggio radio-televisivo, manca ancora però di dati certi sul numero esatto delle persone colpite. «Purtroppo non sono ancora arrivati dati certi», afferma Donato Greco, direttore del Laboratorio di epidemiologia dell’Istituto superiore di sanità, che già da sette anni ha istituito un laboratorio di ricerca in Uganda, proprio all’interno dell’ospedale di Lachor. «Siamo in contatto continuo con il nostro personale sul posto e speriamo di avere presto notizie più certe.
Il virus, osservato per la prima volta nel 1976 in diversi villaggi del Congo, aveva provocato l’ultima epidemia nel Febbraio del 1997 in Gabon, dove uccise 10 persone, ma è stato nel 1995 che Ebola ha colpito nel modo più violento, a Kikwit nello Zaire, dove morirono circa 250 persone. Finora però non aveva mai raggiunto il territorio dell’Uganda. Che cosa può essere accaduto? Probabilmente, dicono le prime ipotesi, un gruppo di soldati governativi, recentemente rientrati a Gulu dal nordest della Repubblica democratica del Congo (dove il virus è endemico), ha trasportato in patria la malattia. Secondo fonti della società civile di Gulu, parecchi militari sarebbero in effetti deceduti nelle settimane successive al rimpatrio.
Il primo caso sospetto risale a circa un mese fa, a questo ne sono presto seguiti altri, fra cui la morte di un medico e due infermiere. Nel frattempo aumentavano i casi di ricovero sospetti, fino a quando la direzione dell'ospedale ha inviato campioni di sangue a qualificati laboratori africani e occidentali. «Per una diagnosi certa sono necessari esami molto complessi, che presuppongono strutture sanitarie ben attrezzate, rare nei territori africani, per cui il virus ha tempo di colpire», spiega Donato Greco. Ma c’è qualche rischio per il nostro paese? «Non ci sono pericoli per l’Italia», risponde il dottor Greco, «perché l’epidemia può raggiungere l’Europa solo se portata da persone infette, ma questa è una delle patologie per cui a livello internazionale c’è massimo allarme, che prevede nei casi sospetti un lungo periodo di quarantena».
Un virus senza scampo
Ebola, provoca febbri emorragiche, molto contagiose e spesso fatali. Le persone colpite iniziano a perdere sangue da tutti gli orifizi del corpo. In nove casi su dieci si muore dissanguati e scossi da febbri alte, dolori alle articolazioni e al petto, dissenterie e cefalee fortissime. Il virus si trasmette fra le persone attraverso il sangue o i rapporti sessuali, ma qualsiasi contatto con i fluidi del corpo (muco, saliva, ecc.) può determinare la contaminazione. Ha un periodo di incubazione che va da due giorni fino a circa tre settimane. Spesso si può propagare proprio grazie alla presenza di ospedali di tipo occidentale, che favoriscono il contatto (fino a qualche anno fa impossibile) tra le persone colpite e il personale sanitario (oltre, naturalmente, agli altri malati).
Come se non bastasse, Ebola è anche un killer terribilmente efficace e ancora largamente misterioso: gli scienziati infatti sanno pochissimo della sua origine, anche perché per studiarlo occorrono laboratori con un altissimo grado di sicurezza (i famosi laboratori P4: in Italia ne è nato uno, il più grande d’Europa, proprio qualche settimana fa presso l’Istituto Spallanzani di Roma). Un mistero nascosto nella grande giungla pluviale africana, dove le sue epidemie sono ricorrenti: quando si risveglia può uccidere con una tale rapidità che bastano poche settimane per fare una strage. Le vittime muoiono così velocemente che spesso non hanno nemmeno il tempo di trasmettere il virus: deve esistere un altro ospite animale, più resistente dell'uomo a questo tipo di virus, in cui esso vive e si moltiplica tra un'epidemia e l'altra. Ma è ancora ignoto chi sia questo misterioso ospite e come trasmetta l'infezione all'uomo. Poiché, tra l'altro, non esiste ancora nessun tipo di vaccino o di cura, ebola resta una delle grandi malattie che prevedono il massimo allarme internazionale e l’isolamento dei casi accertati.
Una voce dall'Uganda
da una lettera di Elio Croce, padre comboniano, in servizio presso il St. Mary Hospital di Lacor in Uganda
Gulu 15-10-00
Carissima D.,
sabato l’altro, per il morbo di Ebola, è morto un infermiere e il cadavere è rimasto insepolto per due giorni per aspettare l’arrivo di un suo fratello. Una grande imprudenza. Nel frattempo mercoledì moriva un’altra allieva infermiera per lo stesso male, così i morti tra gli infermieri sono diventati tre nel giro di dieci giorni. Fin da domenica il dottor Matthew ha contattato le autorità politiche e sanitarie e ha dovuto arrabbiarsi per far capire che la situazione è grave. Intanto ha già preso le misure di emergenza per evitare il contagio: ha fatto isolare due stanzoni e ha fornito medici e infermieri di maschere e vestiti di protezione. Martedì e mercoledì sono arrivate due delegazioni ufficiali, ma a mani vuote, senza informazioni su come comportarsi e senza aiuti. Così Matthew giovedì ha organizzato un incontro con tutti i medici, spiegando la strategia da adottare: svuotare tutti i reparti, esclusi i casi più gravi; ricevere solo le emergenze; disinfettare continuamente i letti e il personale con soluzione di varechina spruzzata con le pompe a mano (quelle dei contadini).
[….] Mentre si svolgeva l’incontro con i medici, hanno avvisato Matthew che erano arrivati finalmente gli esperti tanto attesi, inviati dall’Organizzazione mondiale della sanità. Ma anche queste due persone erano venute solo per vedere che cosa stava succedendo. A questo punto il dottor Matthew ha perso le staffe e li ha letteralmente buttati fuori dall’ospedale dicendo che non sapeva che cosa farsene di gente che veniva per “vedere”, dopo quattro giorni che aveva chiesto aiuto, tre infermieri erano già morti e la gente nei villaggi veniva decimata. Nel frattempo le infermiere sono state prese dal panico di essere contagiate, si sono rifiutate di entrare nei reparti e volevano tornare a casa nei propri villaggi. Allora i medici le hanno riunite e hanno spiegato loro che c’è questo virus emorragico che uccide. Poiché nessuno sa chi può essere già stato contagiato e chi no, se si fossero disperse per tornare a casa avrebbero potuto portare il male con sé, con effetti devastanti nel loro clan e tra i loro parenti. D’altra parte il posto migliore per essere curate in caso di contagio, era proprio qui nell’ospedale di Lacor.
[….] La caposala, che si chiama Maria, fin dal primo giorno ha preso in mano la situazione e si è prodigata senza risparmio assistendo in tutto le persone colpite. Sono pazienti che vomitano, hanno diarrea, perdono sangue da tutte le parti e devono essere puliti in continuazione, 24 ore su 24. Sul suo esempio anche infermiere e studenti si sono dati da fare. Anche adesso, comunque, l’assistenza alle persone colpite si basa sul volontariato. Oggi abbiamo dovuto aprire un altro stanzone perché i malati sono in continuo amento, siamo arrivati a 24. Quattro sono morti tra la notte scorsa e questa mattina, due questo pomeriggio. Per fortuna molti recuperano. Il virus sembra meno aggressivo quando colpisce di nuovo, si attenua passando da una persona all’altra. Tra le persone colpite ci sono altri tre nostri infermieri, ma per ora sembra che abbiano superato la crisi. Per tutti è chiaro che questo virus è stato portato dai soldati di ritorno dallo Zaire. Le ragazze che andavano con loro sono state le prime vittime e poi hanno contagiato tutte le loro famiglie. Il contagio sembra che venga per contatto, così nessuno si stringe più la mano. Nonostante questo ci sono ancora molti parenti dei malati che dormono in ospedale invece che fuori: preferiscono morire di Ebola che essere portati via dai ribelli.
Un forte abbraccio a tutti, sperando che non sia l’ultimo.
Frate Elio
magazine.enel.it/boiler/arretrati/arretrati/boiler13/html/articoli/Adami-Ebol...
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
Incidenza di morbillo in Europa nel periodo 2001-2002
|
 |
by
MedicinaOnline.org Thursday, Oct. 20, 2005 at 12:34 AM |
mail:
|
Incidenza di morbillo in Europa nel periodo 2001-2002
I casi di morbillo segnalati dai Paesi Europei facenti parte del network di sorveglianza EUVAC.net ( A Surveillance Community Network for Vaccine Preventable Infections Diseases ) sono stati 17.928 nel periodo 2001-2002, con un aumento del 41% tra i 2 anni.
L'incidenza è passata da 2,36 per 100.000 persone a 3,37.
La maggior parte dei casi segnalati riguardava bambini di età compresa tra 1 e 9 anni.
L'encefalite , complicanza del morbillo, è stata segnalata in 21 casi nel 2001 ed in 6 casi nel 2002.
Nel 2001 è stato riportato un caso fatale dovuto al morbillo.
L'incidenza di morbillo in soggetti non vaccinati è passata dal 50% nel 2001 al 66% nel 2002. ( Xagena_2003 )
Muscat M et al, Euro Surveill 2003; 8:123-129
www.xagena.it/news/e-vaccini_it_news/6069cecf34adb1d6db60007da39e2ee8.html
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
 |
una scusa per non confessare di soffrire di attacchi di panico e soprattutto il terrore di
|
 |
by
Tempo aver paura di voler provare a vivere ! Thursday, Oct. 20, 2005 at 12:40 AM |
mail:
|
(28/06/2005)
Tempo di vacanze e paura di volare
Paura di partire, di prendere il treno, di viaggiare in auto ma soprattutto paura di volare: si può dire che l'inizio dell'estate, tempo di partenze, per molti significa tempo di paure. Trentasette milioni di italiani stanno cercando la vacanza ideale, ma due milioni stanno invece rifugiandosi nella scusa più credibile per non partire, una scusa per non confessare di soffrire di attacchi di panico e soprattutto il terrore di volare.
Rimangono in città soli e al caldo perché non sanno che basta una cura di pochi giorni per superare questa paura che non è una "fissazione" come molti affermano, ma un reale attacco di panico che, come problema sociale verrà discusso in Parlamento.
E oggi ci sono anche le conferme e le prove che l'anidride carbonica (CO2), un tempo solo sospettata di innescare attacchi di panico in aereo o in metro, adesso può esserne giudicata responsabile. E' stato Rosario Sorrentino il primo studioso a parlare di CO2 come responsabile degli attacchi di panico sugli aerei e la cura per guarire dalla paura di volare, nel corso di un incontro svoltosi questa mattina a Roma al quale hanno partecipato anche i professori Stefano Bastianello (Direttore Servizio di Neuroradiologia - Università di Pavia), Livio de Santoli (Ordinario di Impianti Tecnici - Università La Sapienza di Roma) e l'onorevole Renzo Lusetti (Vice Capo Gruppo Margherita alla Camera - Commissione Trasporti).
L'ultima dimostrazione che parte dell'umanità sia afflitta dalla "paura di volare" viene anche da un sondaggio del TG2 che ha intervistato 2000 persone: il 46 % degli intervistati ha detto di aver paura di volare, solo il 32 ha affermato di non avere problemi, mentre il 43% rinuncia ai viaggi in aereo. Il 54 per cento ha detto di preferire l'auto per andare in vacanza; il 27 per cento l'aereo; il 13 per cento il treno e il 6 la nave.
Ma di paura di volare si guarisce. "Adesso esistono - ha affermato Rosario Sorrentino, neurologo, dell'Unità Italiana Attacchi Panico della Paideia a Roma - terapie mirate soprattutto quella farmacologica ma anche la psicoterapia cognitivo-comportamentale. Il metodo, da me messo a punto e sperimentato, prevede sia per chi vive il volo con ansia e forte apprensione, sia per chi rifiuta l'aereo in modo ostinato che per chi ha avuto o ha attacchi di panico durante il volo, di assumere cinque-sei giorni prima del volo previsto una terapia farmacologica mirata e calibrata alla persona.
La cura sarà efficace a mettere in stand by quei sensori e quei centri nervosi che nel nostro cervello fanno scattare all'improvviso gli attacchi di panico. Gli stessi farmaci vanno presi anche al momento dell'arrivo in aeroporto e se necessario durante il viaggio. Successivamente alla terapia farmacologica mirata e calibrata alla persona, ci si sottopone alla psicoterapia cognitivo-comportamentale. Le due metodiche consentono al paziente di desensibilizzarsi progressivamente e di riabilitarsi ad esporsi alle situazioni temute".
Nel corso dell'incontro è stato illustrato uno studio italiano che, per la prima volta, ha "fotografato" un attacco di panico ed il percorso che questo compie nel cervello. In particolare, con la Risonanza Magnetica funzionale si è riusciti a "vedere" nel cervello non solo il momento in cui il soggetto immagina o vive una situazione che potrebbe scatenare la paura ma anche il momento in cui avverte la paura. L'eccezionale documento è il risultato di uno studio condotto dal prof. Rosario Sorrentino e dal prof. Stefano Bastianello.
"Anni fa - ha detto Bastianello - colleghi americani sono riusciti a catturare l'immagine di un attacco di panico, utilizzando la PET, uno strumento invasivo che usa isotopi radioattivi. Adesso invece siamo riusciti a "fotografare" l'attacco di panico e il suo percorso nel cervello con la Risonanza Magnetica funzionale. Non è stato facile giungere a questo risultato perché non è possibile intervenire con la strumentazione al momento dell'insorgenza dell'attacco. Recenti teorie neuro-anatomiche hanno proposto l'estensivo coinvolgimento del sistema limbico nella patogenesi e nel controllo degli attacchi di panico; inoltre è dimostrato che per questi soggetti è sufficiente pensare a determinate situazioni che creano loro paura ed ansia perché si manifestino le alterazioni anatomo-psicologiche caratteristiche dell'evento acuto (alterazioni della frequenza cardiaca, della pressione sanguigna e del respiro). Quest'ultima affermazione è quindi il presupposto essenziale per l'esecuzione dello studio.
Tutti i soggetti prima dell'esame descrivono gli episodi, precedentemente vissuti, che hanno loro suscitato attacchi di panico e/o paura di volare, eventi che vengono poi riproposti dall'operatore ai soggetti durante l'esecuzione dell'esame al fine di evidenziare appunto l'attivazione di specifiche aree corticali. Utilizzando un apparecchio di RM ad alto campo viene applicato uno schema a blocchi, in cui si alternano periodi di stimolazione (proposizione di un evento che aveva suscitato al soggetto paura di volare) e periodi di quiete (proposizione di un evento indifferente per il soggetto in esame).
Le immagini ottenute, dopo essere state preliminarmente rielaborate attraverso uno specifico sistema di applicazione (SPM 2), vengono elaborate per ottenere "mappe" di attivazione corticale che descrivono le aree che si attivano durante la riproduzione del panico. In sostanza, nei pazienti con attacchi di panico e paura di volare le regioni del cervello coinvolte, che possono essere studiate e quantificate con la RM funzionale, sono la regione frontale inferiore, il giro del cingolo e l'ippocampo".
Nel corso dell'incontro i professori Sorrentino e Bastianello hanno evidenziato che in presenza delle "fotografie" dell'attacco di panico, e conoscendo esattamente le regioni del cervello coinvolte nel processo, è possibile utilizzare farmaci mirati. "Da molto tempo - ha affermato Bastianello - clinici, in particolare i neurologi, sostenevano che alcune aree corticali differenti, ciascuna con una propria funzione e sensibile a diversi e specifici stimoli sia esogeni che endogeni, fossero coinvolte nel processo degli attacchi di panico. Adesso c'è la "fotografia" a dimostrarlo".
Responsabile degli attacchi panico può essere, come già evidenziato, anche l'anidride carbonica, sotto accusa sugli aerei. Il prof. Livio de Santoli, esperto di qualità dell'aria negli ambienti chiusi, ha evidenziato il rapporto fra anidride carbonica nella cabina di un aereo e un attacco di panico.
"Rilevazioni sperimentali - ha spiegato - hanno riscontrato alti livelli di anidride carbonica (CO2), specie al decollo e all'atterraggio, sempre superiori al livello ritenuto accettabile per il comfort anche se lontani dai limiti di pericolosità. I valori riscontrati elevati sono conseguenza dell'elevato tasso di affollamento, del regime di ventilazione adottata negli aerei e dei mezzi filtranti impiegati. Nella cabina viene mantenuta una pressione di 0,75 atm per contrastare quella presente nell'ambiente esterno di 0,5 atm (10000 m). A tali valori di pressione (25% inferiore a quella atmosferica) sorgono difficoltà respiratorie che peggiorano l'effetto nocivo delle alte concentrazioni di CO2.
Così come, effetto non trascurabile, tutto il fenomeno viene influenzato dal valore molto basso di umidità relativa (30%) mantenuto negli aerei. La cabina dell'aereo rappresenta uno spazio in cui le condizioni di vita risultano critiche. Con un metro cubo di spazio disponibile per ogni viaggiatore, nell'ipotesi di assenza totale di ventilazione, in 15 minuti si raggiungerebbero le concentrazioni ritenute pericolose di CO2 (5000 ppm)".
In uno spazio limitato - ha continuato de Santoli - le condizioni dell'individuo non possono essere considerate normali e anche la sua produzione di CO2 aumenta ben al di sopra dei suoi valori standard (20 litri per persona per ora in condizioni di sedentarietà). Negli aerei la ventilazione fornisce valori di ricambio di aria esterna che vanno da 5 anche fino a 2 L/s pers di aria esterna (rispettivamente il 50% e il 20% di quanto imposto per la vivibilità negli uffici dove lo spazio considerato per ogni persona è 20 volte superiore)".
Il prof. de Santoli si è poi soffermato sui costi per ridurre questo inconveniente a bordo di un aereo. "Ridurre il tasso di ventilazione esterna - ha detto de Santoli - significa risparmiare energia e quindi soldi: è stato valutato un costo di 6 cent$/h pers (con ventilazione di 2,5 L/s pers) contro i 18 cent$/h pers (con ventilazione di 7 L/s pers), con un risparmio netto di 12 cent$/h pers. Tale risparmio comunque significa meno di 1 $ a passeggero/viaggio di media tratta (5 ore), sovraccosto del tutto trascurabile se rapportato alla probabile insorgenza di problemi individuali".
La paura di volare atterra in Parlamento. L'onorevole Renzo Lusetti sta infatti predisponendo un'iniziativa parlamentare per attivare una serie di provvedimenti. L'iniziativa è stata illustrata dallo stesso onorevole nel corso dell'incontro tutto dedicato alle problematiche medico-scientifiche, ma anche sociali, legate a quell'angoscia che attanaglia tanta gente e che impedisce di partire e soprattutto di volare.
"Sto lavorando - ha detto Lusetti - a un'iniziativa che mira ad incentivare Corsi di formazione del personale medico specializzato in grado di aiutare quanti soffrono di attacchi di panico. Nell'iniziativa parlamentare, di cui ovviamente interesserò i colleghi di tutti i Gruppi, è prevista anche la proposta di avviare un'indagine conoscitiva, a livello scientifico, per accertare se l'incidenza dell'anidride carbonica a bordo degli aerei sia superiore a quella prevista dall'Organizzazione Mondiale della Sanità come limite massimo da raggiungere e cioè 400 ppm (parti per milione). Il mondo scientifico sostiene che l'anidride carbonica, in quantità elevate, può incidere sull'insorgenza di un attacco di panico.
Infine, la mia iniziativa parlamentare mira anche a riportare sul tappeto il problema della presenza di un medico sui voli intercontinentali. Mi rendo conto che questa figura sull'aereo è molto importante ma nello stesso tempo sono convinto che l'inserimento di un medico specializzato fra i componenti dell'equipaggio richieda alle Compagnie un impegno economico non indifferente. E' un problema che comunque in sede parlamentare dovrebbe essere discusso. Certo è che gli attacchi di panico stanno diventando, oltre che un problema medico, anche un problema sociale che coinvolge non solo chi degli attacchi soffre ma anche i familiari e quanti altri sono vicini".
www.saluteeuropa.it/news/2005/06/0628004.htm
|
 |
| versione
stampabile | invia ad un amico
| aggiungi un
commento | apri un dibattito
sul forum |
 |
|

